【摘要】蜂胶是一种具有广泛药理学活性的蜂产品。虽然不同地区、不同来源的蜂胶成分差异很大,但各种蜂胶所具有的生物学活性基本类似。就国内外蜂胶及其单体活性成分的抗炎作用及其分子机制进行综述,旨在为蜂胶生物学活性的基础性研究提供思路,并为蜂胶产品的标准化提供参考。
【作者】 王凯 张江临 胡福良
【关键词】蜂胶 炎症 咖啡酸苯乙酯 阿替匹林C 分子机制
蜂胶是由意大利蜜蜂Apis mellifera ligustica的工蜂采集植物树脂等分泌物与其上颚腺、蜡腺等分泌物混合形成的胶黏性物质。蜂胶是一种传统的天然药物,在欧洲的应用历史已有2 000多年。由于中华蜜蜂Apis cerana Fabricius不产蜂胶,我国历史文献中对蜂胶的生产和应用记载不多。《神农本草经》中记载的“露蜂房”,其主要成分是蜂蜡、蜂胶(树脂)和蜂房油3种,具有“主治惊疾、寒热邪气、癫疾、肠痔”的作用。相对来说,我国研究、开发蜂胶比国外要晚得多,但20世纪90年代以来,我国开始对蜂胶的成分、性质、药理和临床应用等进行了大量研究,蜂胶产品的开发应用得到了迅猛的发展,已成为我国蜂产品研究和开发的热点。蜂胶现已收载于《中国药典》2010年版一部。同其他蜂产品一样,蜂胶具有广泛的药理学活性,如抗菌[1-2]、抗病毒[3]、抗病原虫[4]、抗氧化[5-6]、抗癌[7-8]、麻醉[9]、创伤修复[10]、消炎[11-13]、免疫调节[14-15]、预防龋齿[16-17]、心血管保护[18-19]等。也正是由于蜂胶具有多重药理活性,蜂胶产品在市场上受到广大消费者的青睐,现已广泛应用于医药、保健食品、化妆品等领域。
蜂胶具有良好的抗炎效果,这也是蜂胶最早受到关注的药理学活性之一。早在公元前300多年古希腊科学家亚里士多德在其所著的《动物志》中就记载了蜂巢中一种具有刺激性气味的“黑蜡(”蜂胶)能治疗皮肤病、化脓和刀伤[20];更有报道在19世纪末南非布尔战争中,蜂胶已被用于外伤治疗[21-22]。近些年来针对蜂胶及其主要生物活性成分抗炎效果的研究,特别是对蜂胶抗炎作用机制方面的研究工作已经受到广泛关注。本文针对不同种类蜂胶及其单体活性成分所具有的抗炎活性及其可能的分子机制进行综述,为对蜂胶这一宝贵天然产物的开发和利用提供依据,同时也为蜂胶产品的标准化及质量控制提供参考。
1 蜂胶的抗炎活性
炎症(inflammation)是机体组织受外界有害刺激(如病原体、受损细胞或其他刺激物等)时所产生的一种保护性应答反应[23],同时局部组织会发生变质、渗出和增生等病理性变化。蜂胶是一种具有良好抗炎效果的天然产物,大量研究针对不同地理来源蜂胶及蜂胶中的主要单体成分的抗炎活性进行了广泛研究。
1.1 蜂胶提取物的抗炎活性
研究蜂胶提取物的炎症模型主要包括角叉菜胶致大鼠足肿胀模型、醋酸致小鼠腹腔毛细血管通透性增高模型、角叉菜胶致大鼠胸膜炎模型、油酸加脂多糖(LPS)致大鼠急性肺损伤模型、小鼠棉球肉芽肿慢性炎症模型、完全弗式佐剂致大鼠免疫性炎症模型等。这些研究也都证实蜂胶针对急性炎症[11,13]、慢性炎症[15,24]均具有良好的抑制效果。由此推测蜂胶中的一些活性成分能有效抑制环氧合酶的活性,从而减少了前列腺素E2的生成;同时还发现蜂胶中的某些物质是脂氧合酶抑制剂,抑制白细胞三烯的生成,缓解炎症的发生。蜂胶提取物抗炎相关研究见表1。
表1不同来源蜂胶提取物的抗炎效果
Table 1 Anti-inflammatory effects of propolis extracts from different sources


WEP-蜂胶水提液;EEP-蜂胶乙醇提取液;MEP-蜂胶甲醇提取液;HAEP-蜂胶水醇提取液
WEP-water extract of propolis;EEP-ethanol extract of propolis;MEP-methanol extracts of propolis;HAEP-hydroalcoholic extract of propolis
1.1.1 蜂胶水提液的抗炎活性
Moura等[34]研究了巴西蜂胶水提液对小鼠慢性炎症的影响,结果表明蜂胶水提液可抑制细胞移行,同时胶原沉积并没有受到影响,说明蜂胶水提液能在不影响组织器官修复的前提下抑制慢性炎症的发生。蜂胶水提液中具有抗炎、促进伤口愈合作用的主要活性成分为咖啡奎宁酸及苯丙酯类物质。其他一些针对蜂胶水提液的研究还发现其具有抗血小板凝集、抑制前列腺素E2(PGE2)合成、神经保护、免疫调节等作用,并能通过抑制5-脂氧合酶(5-lipoxygenase,5-LOX)的活性发挥抗炎效果[26,37-38]。
1.1.2 蜂胶醇提液的抗炎活性
相对于蜂胶水提液而言,蜂胶中多数有效成分也可以被醇提取,乙醇萃取法也是蜂胶各种提取方式中最传统、最经典的一种。Park等[28]利用小鼠佐剂性关节炎模型、角叉菜胶诱导足跖肿胀模型研究蜂胶醇提液对急慢性炎症的影响,结果发现蜂胶醇提液剂量为50mg/kg和100mg/kg时能显著降低关节炎指数。同时一次性口服剂量为200mg/kg,能显著减轻由角叉菜胶诱导的小鼠足跖肿胀程度。推测蜂胶抗炎活性可能同抑制PGE2的生成有关。
蜂胶醇提液能对非特异性免疫反应产生影响,其主要的影响途径是通过激活巨噬细胞实现的。Orsi等[29]研究发现蜂胶醇提液能减少炎症过程中的H2O2、NO的产生,且呈剂量相关性。Missima等[24]通过对应激状态下的小鼠的巨噬细胞功能及相关免疫器官的组织病理学研究发现,巴西绿蜂胶醇提液也能显著影响应激状态下小鼠巨噬细胞H2O2的产生,并抑制NO的生成。这主要是因为蜂胶能通过影响核因子-κB(NF-κB)信号通路从而抑制诱导型NO合酶(iNOS)基因的转录,进而减少iNOS产生及抑制iNOS催化合成NO的能力[30,32]。
1.1.3 蜂胶水提液、醇提液抗炎效果的比较研究
胡福良等[11-12]通过研究蜂胶醇提液和水提液对小鼠急性炎症的影响,发现无论是蜂胶醇提液还是水提液对急性炎症均有明显的抑制作用,特别是蜂胶醇提液、水提液均对急性炎症渗出液中NO及溶菌酶量的升高表现出强烈地抑制作用。后续研究还证实蜂胶提取液对慢性炎症也具有显著的抑制作用。对相关细胞因子水平的变化研究发现,蜂胶提取液主要作用于B淋巴细胞系统。但蜂胶水提液、醇提液抗炎作用的物质基础并不相同,蜂胶醇提液发挥抗炎作用主要是其中富含醇溶性的黄酮类化合物,而蜂胶水提液中主要含有一些水溶性酚酸类化合物而发挥作用。但就抗炎效果而言,蜂胶水提液的抗炎效果同醇提液是基本类似的[13,39]。
1.1.4蜂胶提取液对炎症因子、细胞因子产生的影响
在对蜂胶抗炎作用研究过程中,发现蜂胶提取液不仅能抑制NO的产生、减少PGE2的生成[27,31],同时也通过对相关细胞因子的影响发挥着免疫调节作用。Hu等[31]研究发现蜂胶醇提液、水提液能显著抑制小鼠炎症部位IL-6水平的上升,但对IL-2及IFN-γ的水平无明显影响。Sa-Nunes等[40]研究发现蜂胶能减少由刀豆蛋白A(concanavalin A,Con A)刺激造成的脾细胞增生,同时增加IFN-γ的生成。Sforcin[22]认为蜂胶抑制淋巴细胞增生的主要原因是蜂胶影响了一些调节性细胞因子的产生,如转化生长因子-β(TGF-β)、IL-10等;而蜂胶的抗炎、抗新血管生成主要是通过影响TGF-β1而实现的[33]。最近的研究还发现蜂胶能显著抑制病理状态下免疫细胞IL-8、17的产生[35-36]。同时,Orsatti等[15,41]最新研究发现蜂胶对小鼠巨噬细胞的Toll样受体(Toll-likereceptors,TLR)-2、4的表达也有一定的影响,特别是在应激状态下,蜂胶能通过下调小鼠TLR-2、TLR-4的mRNA表达水平从而发挥免疫调节作用。TLR在免疫系统,特别是天然免疫反应中发挥着重要作用,同时与细胞因子的产生、免疫细胞的激活也有着一定联系[42-43]。
值得注意的是,由于蜂胶成分非常复杂,不同种类、不同来源的蜂胶中活性成分差异很大,而且实验采用的炎症模型也不尽相同,这也导致实验结果并不十分一致,特别是关于蜂胶抗炎活性的分子机制方面国内外并没有一个统一的认识。未来的研究有必要在分析确定蜂胶药效成分的基础上对蜂胶各种药理学活性作用成分单体进行进一步深入探讨,同时针对不同地区、不同植物来源的蜂胶作用机制进行研究,制定一个相对普遍的评价标准。
1.2蜂胶中具有抗炎作用的生物活性成分单体
针对蜂胶中生物活性成分单体的报道近几年来逐渐呈上升趋势。越来越多的研究证实蜂胶中丰富的黄酮类、酚酸类化合物是蜂胶具有多种生物学活性的主要物质基础。蜂胶中具有良好抗炎效果的化合物主要包括:黄酮类化合物槲皮素(quercetin)、柯因(chrysin)、高良姜素(galangin)、山柰酚(kaempferol)等和酚酸类化合物咖啡酸(caffeic acid)、阿魏酸(ferulic acid)、肉桂酸(cinnamic acid)等,同时还包括一些酚酸的衍生物如咖啡酸苯乙酯(caffeic acidphenethyl ester,CAPE)、阿替匹林C(Artepillin C,3,5-二异戊烯基-4-羟基肉桂酸)等。蜂胶醇提液、水提液中主要生物活性成分的化学结构见图1、2。
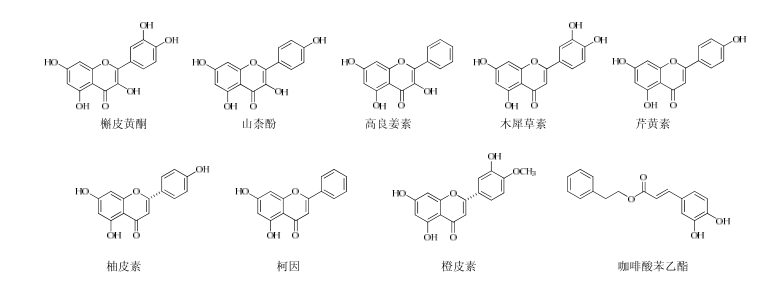
图1蜂胶醇提物中主要的生物活性成分
Fig.1 Main bioactive constituents in alcohol extract of propolis
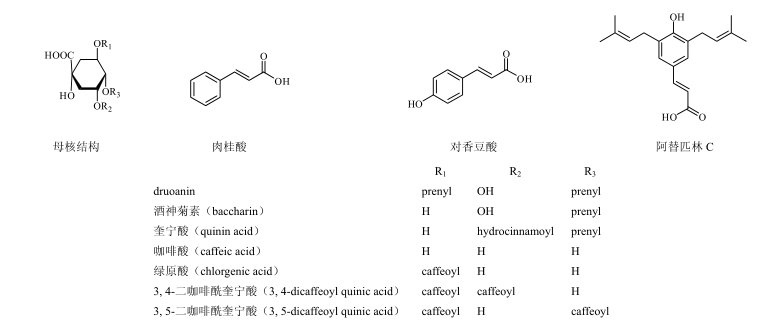
图2蜂胶水提物中主要的生物活性成分
Fig.2 Main bioactive constituents in water extract of propolis
1.2.1 蜂胶中黄酮类化合物的抗炎作用
蜂胶中富含黄酮类化合物,其良好的抗炎活性同所含黄酮类化合物的种类、量密切相关。Woo等[44]研究了柯因对LPS刺激RAW264.7细胞株的影响,结果发现柯因能显著抑制LPS刺激下的环氧合酶-2(COX-2)mRNA和蛋白表达水平,并通过突变体分析及凝胶电泳迁移率实验(electrophoretic mobility shiftassay,EMSA)结果表明,柯因可影响IL-6的转录。Raso等[45]研究发现槲皮素、高良姜素、芹黄素和柚皮素能显著降低J774A.1细胞COX-2的表达与PGE2的生成。同时,蜂胶中的酚酸类化合物也有较强的抗炎活性。动物实验证明咖啡酸能抑制花生四烯酸的生成,同时抑制COX-2的活力,且能抑制COX-2基因的表达[46]。阿魏酸对神经系统有着很好的保护作用,这主要是由于其具有良好的抗炎效果和自由基清除能力,同时也能抑制细胞间黏附因子(intercellular adhesion molecule-1,ICAM-1)的产生和NF-κB的转录[47]。
针对蜂胶及其多酚类化合物对LPS刺激下巨噬细胞NO和iNOS产生量的影响实验发现,多酚类化合物中起主要作用的是黄酮类物质,特别是黄酮和异黄酮。Hamalainen等[48]系统地研究了36种黄槲皮黄酮山柰酚高良姜素木犀草素芹黄素柚皮素柯因橙皮素咖啡酸苯乙酯HOOCHOOR2OR1OR3OHHOOOHOOHHO O母核结构肉桂酸对香豆酸阿替匹林C酮类化合物的体外抗炎效果,发现其中的8种黄酮类化合物能有效抑制LPS刺激下细胞NO和iNOS的产生,且都能抑制NF-κB的活力。其中,染料木素、山柰酚、槲皮素、大豆苷元不仅能抑制NF-κB,还能抑制STAT-1(iNOS另外一个重要的转录因子)的转录活性。Wang等[49]对几种黄酮醇类化合物的抗氧化及抗炎效果进行了研究,包括非瑟酮、山柰酚、桑色素、杨梅酮和槲皮黄酮,结果发现这些黄酮醇类化合物都有很好的抗氧化性能,对几种不同种类的自由基都有清除作用,且都有一定的抗炎功效,但作用效果不完全一致。
1.2.2 CAPE的抗炎作用
CAPE是蜂胶中另外一种重要的活性组分,也是蜂胶中研究利用最早、最广泛的一种单体成分。其具有多种生物学活性,如抗肿瘤[50-51]、抗氧化[52]、免疫调节[53]、抗病毒[3]、抗菌消炎[54-55]等。研究发现CAPE能刺激T细胞增殖,并抑制相关细胞因子的产生,从而发挥抗炎的效果。对CAPE抗炎作用的分子机制研究发现,CAPE本身就是一种强有力的NF-κB抑制物,能通过抑制NF-κB信号通路发挥抗炎效果,而NF-κB在转录水平调节COX-2和iNOS基因的表达,并控制着许多细胞因子基因的转录,如肿瘤坏死因子-α(TNF-α)、IL-1等[3,56-58]。
1.2.3阿替匹林C的抗炎作用
同其他地区蜂胶富含黄酮类化合物不同,巴西绿蜂胶中主要活性成分是一些酚酸类化合物,特别是富含阿替匹林C,其也是巴西绿蜂胶中一种特有的活性成分,具有抗微生物、抗氧化、抗肿瘤、抗炎等多种药理活性[59]。Paulino等[60]采用角叉菜胶致小鼠足跖肿胀模型、致小鼠腹膜炎模型,测定RAW264.7细胞产生的NO水平、HEK293细胞中NF-κB活性,研究了阿替匹林C的抗炎效果,并研究了阿替匹林C的吸收率及生物利用率。结果表明阿替匹林C对小鼠足跖肿胀最多有38%的抑制效果,并显著减少患腹膜炎小鼠中性粒细胞的水平,同时细胞实验也证实了阿替匹林C可以减少NO的产生,同时能降低NF-κB的转录活性。
2 蜂胶抗炎作用的分子机制
尽管导致炎症发生原因多种多样,但一般认为炎症是由化学媒介物直接诱导产生的。目前已研究确认同炎症过程有关的化学媒介物主要包括血管活性胺(如组胺、5-羟色胺等)、类花生酸物质(如PGE和白细胞三烯等)、血小板凝聚因子、细胞因子(IL、TNF等)、激肽(缓激肽)、氧自由基等。虽然不同地区、不同植物来源的蜂胶组成成分及活性成分差别很大,但各种类型的蜂胶都具有相似的生物学功能,如抗氧化、抗癌、抗菌消炎等。早在20世纪90年代人们就已经开始了蜂胶药理作用机制方面的研究,特别是蜂胶抗炎和抗氧化作用机制一直受到广泛关注。总的来说,蜂胶及其活性成分的抗炎机制主要是通过抑制炎症相关信号通路[NF-κB、丝裂原活化蛋白激酶(MAPK)等]的转导,并通过影响这些化学媒介物的产生而发挥抗炎作用。其可能存在的作用机制见图3。

图3蜂胶抗炎作用的分子机制
Fig.3 Molecular mechanism of anti-inflammatory effects of propolis
2.1 影响花生四烯酸代谢通路
炎症过程中花生四烯酸代谢通路起着非常重要的作用。花生四烯酸的代谢主要通过2种途径完成,包括环氧化酶(COX)途径和脂氧合酶(LO)途径。而机体受到的外界刺激会使COX-2表达量升高,从而催化合成大量的前列腺素类物质(PGE2等),引起和加重炎症反应。蜂胶和蜂胶中的活性成分能通过抑制COX-2基因的表达,抑制该酶的活力,从而影响了花生四烯酸的代谢,减少PGE2的生成。
2.2 影响L-精氨酸代谢通路
除了上述提到的花生四烯酸代谢通路外,通过L-精氨酸代谢通路产生的NO也对炎症的发生发展起着非常重要的作用。NO是具有高度反应性的自由基,在体内作为一种细胞信号分子广泛存在,并在炎症反应中起着非常重要的作用。在炎症过程中,L-精氨酸在iNOS的作用下催化合成大量的NO,造成细胞损伤,引起细胞相关病理反应。而蜂胶及蜂胶中的活性成分能通过抑制iNOS的表达而减少NO的生成量,发挥抗炎作用。
2.3 抑制NF-κB信号通路的激活
NF-κB是一种重要的转录因子,因其能与免疫球蛋白κ链基因结合增强其转录而得名。NF-κB信号通路同许多炎症、免疫相关基因的转录都有关系。在上游信号刺激下,同NF-κB蛋白结合的NF-κB抑制蛋白(IκBα)会发生磷酸化,磷酸化后的IκBα会同NF-κB分离开来,并在蛋白酶体的作用下发生降解。同IκBα分离开的NF-κB很快就会从细胞质转移进细胞核,进核后的NF-κB响应原件会结合在相关基因的κB位点上,从而可以起始下游基因的转录。与炎症过程相关的一些基因如TNF-α、IL-12、IL-1β、IL-5等及一些生物酶类如磷脂酶A2(sPLA2)、COX-2、低密度脂蛋白受体(LOX)、NOS等都含有NF-κB结合位点,因此NF-κB的转录活性也是炎症发生发展过程中的关键因素。同时由于蜂胶中含有大量的黄酮类、酚酸类物质如咖啡酸、阿魏酸、CAPE、阿替匹林C、槲皮素、柯因等,能有效抑制炎症因子的生成,并能直接或间接地抑制NF-κB信号通路的激活,从而也抑制了相关基因的转录,有效缓解炎症对细胞造成的伤害。
3 结语与展望
随着对蜂胶研究的不断深入,对其药理学活性的认识也会越来越全面、深入。同时,不同种类的蜂胶的药理学活性已在临床上得到了证实,与蜂胶相关的保健品也已上市。需要指出的是蜂胶成分复杂,且不同活性成分的作用机制不尽相同,简单地把蜂胶的各种生物活性看成是活性成分协同作用的结果并不是完全科学的。以蜂胶的抗炎活性为例,目前的研究已经阐明这是蜂胶中某种或某几种主要成分(柯因、CAPE、阿替匹林C等)作用的结果,它们在蜂胶中量的多少也会直接影响蜂胶抗炎作用的强弱。从这个角度来看,尽管不同地区、不同来源的蜂胶组成成分差异巨大,但从蜂胶中主要活性成分出发,联系其生物活性,一定能更好地解释蜂胶的作用机制,同时也能促进蜂胶产品标准化的推进。
参考文献
[1] Silva J C,Rodrigues S,Feás X,et al.Antimicrobial activity,phenolic profile and role in the inflammation ofpropolis[J].Food Chem Toxicol,2012,50(5):1790-1795.
[2] Mihai C M,Marghita L A,Dezmirean D S,et al.Interactions among flavonoids of propolis affectantibacterial activity against the honeybee pathogenPaenibacillus larvae[J].J Inverteb Pathol,2012,110(1):68-72.
[3] Shvarzbeyn J,Huleihel M.Effect of propolis and caffeicacid phenethyl ester(CAPE)on NF kappa B activation byHTLV-1 Tax[J].Antiv Res,2011,90(3):108-115.
[4] Gressler L T,Da Silva A S,Machado G,et al.Susceptibility of Trypanosoma evansi to propolis extractin vitro and in experimentally infected rats[J].ResVeterin Sci,2012,93(3):1314-1317.
[5] Abu-Mellal A,Koolaji N,Duke R K,et al.Prenylatedcinnamate and stilbenes from Kangaroo island propolisand their antioxidant activity[J].Phytochemistry,2012,77:251-259.
[6] 钟立人,韩文辉,张燕萍.蜂胶抗氧化性能的研究[J].中草药,2002,33(9):803-804.
[7] Sulaiman G M,Ad'hiah A H,Al-Sammarrae K W,et al.Assessing the anti-tumour properties of Iraqi propolis invitro and in vivo[J].Food Chem Toxico,2012,50(5):1632-1641.
[8] Dornelas C A,Fechine-Jamacaru F V,Albuquerque I L,etal.Chemoprevention with green propolis green propolisextracted in l-lysine versus carcinogenesis promotion withl-lysine in n-butyl-n-[4-hydroxybutyl]nitrosamine(bbn)induced rat bladder cancer[J].Acta Cirurgica Brasileira,2012,27(2):185-192.
[9] Araujo M A R,Libério S A,Guerra R N M,et al.Mechanisms of actionunderlying the anti-inflammatoryand immunomodulatory effects of propolis:A briefreview[J].Brazilian J Pharm,2011,22(1):208-219.
[10] Chirumbolo S.Flavonoids in propolis acting on mastcell-mediated wound healing[J].Inflammopharmacology,2012,20(2):99-101.
[11] 胡福良,李英华,陈民利,等.蜂胶醇提液和水提液对急性炎症动物模型的作用[J].浙江大学学报:农业与生命科学版,2003,29(4):444-448.
[12] 胡福良,李英华,朱威,等.蜂胶对大鼠佐剂性关节炎的作用及其机制的研究[J].中国药学杂志,2005,40(15):1146-1148.
[13] 胡福良,李英华,朱威,等.蜂胶提取液对大鼠急性胸膜炎的作用及其机制的研究[J].营养学报,2007,29(2):189-191.
[14] Ohkura N,Takata Y,Ando K,et al.Propolis and itsconstituent chrysin inhibit plasminogen activator inhibitor1 production induced by tumour necrosis factor-αandlipopolysaccharide[J].J Apicultural Res,2012,51(2):179-184.
[15] Orsatti C L,Sforcin J M.Propolis immunomodulatoryactivity on TLR-2 and TLR-4 expression by chronicallystressed mice[J].Nat Prod Res,2012,26(5):446-453.
[16] Gazzani G,Daglia M,Papetti A.Food components withanticaries activity[J].Curr Opin Biotechnol,2012,23(2):153-159.
[17] Bravo Venero A V,Díaz García L M,González L A.Treatment of dental alveolitis with 5%propolis tincture[J].Rev Cubana Farm,2012,46(1):97-104.
[18] 杨明,隋殿军,孙红,等.蜂胶总黄酮抗心肌缺血作用[J].中草药,2006,37(2):253-255.
[19] 刘芬,岳海涛,吕文伟,等.蜂胶总黄酮对急性心肌梗死犬血清微量元素及心肌超微结构的影响[J].中草药,2010,41(4):621-622.
[20] 胡福良.蜂胶药理作用研究[M].杭州:浙江大学出版社,2005.
[21] Ghisalberti E L.Propolis:a review[J].Bee World,1979,60:59-84.
[22] Sforcin J M.Propolis and the immune system:a review[J].J Ethnopharmacol,2007,113(1):1-14.
[23] Coussens L M,Werb Z.Inflammation and cancer[J].Nature,2002,420(6917):860-867.
[24] Missima F,Sforcin J M.Green Brazilian propolis actionon macrophages and lymphoid organs of chronicallystressed mice[J].Evid Based Complement Alternat Med,2008,5(1):71-75.
[25] Dobrowolski J W,Vohora S B,Sharma K,et al.Antibacterial,antifungal,antiamoebic,antiinflammatoryand antipyretic studies on propolis bee products[J].JEthnopharmacol,1991,35(1):77-82.
[26] Khayyal M T,Elghazaly M A,Elkhatib A S.Mechanismsinvolved in the anti-inflammatory effect of propolisextract[J].Drugs Exp Clin Res,1993,19(5):197-203.
[27] Mirzoeva O K,Calder P C.The effect of propolis and itscomponents on eicosanoid production during theinflammatory response[J].Prostaglandins LeukotrienesEssent Fatty Acids,1996,55(6):441-449.
[28] Park E H,Kahng J H.Suppressive effects of propolis inrat adjuvant arthritis[J].Arch Pharm Res,1999,22(6):554-558.
[29] Orsi R O,Funari S R C,Soares A M V C,et al.Immunomodulatory action of propolis on macrophageactivation[J].J Venom AnimToxins,2000,6:1-17.
[30] Song Y S,Park E H,Hur G M,et al.Ethanol extract ofpropolis inhibits nitric oxide synthase gene expressionand enzyme activity[J].J Ethnopharmacol,2002,80(2/3):155-161.
[31] Hu F,Hepburn H R,Li Y,et al.Effects of ethanol andwater extracts of propolis(bee glue)on acuteinflammatory animal models[J].J Ethnopharmacol,2005,100(3):276-283.
[32] Tan-No K,Nakajima T,Shoji T,et al.Anti-inflammatoryeffect of propolis through inhibition of nitric oxideproduction on carrageenin-induced mouse paw edema[J].Biolo Pharm Bull,2006,29(1):96-99.
[33] de Moura S A L,Ferreira M,Andrade S P,et al.Braziliangreen propolis inhibits inflammatory angiogenesis in amurine sponge model[J].Evid Based ComplementAlternat Med,doi:10.1093/ecam/nep197,2011.
[34] de Moura S A L,Negri G,Salatino A,et al.Aqueousextract of brazilian green propolis:Primary components,evaluation of inflammation and wound healing by usingsubcutaneous implanted sponges[J].Evid BasedComplement Alternat Med,doi:10.1093/ecam/nep112,2011.
[35] Skiba M,Szliszka E,Kunicka M,et al.Effect of ethanolextract of propolis(EEP)on interleukin 8 release byhuman gastric adenocarcinoma cells(AGS)infected withHelicobacter pylori[J].Central Eur J Immunol,2011,36(2):65-69.
[36] Tanaka M,Okamoto Y,Fukui T,et al.Suppression ofinterleukin 17 production by Brazilian propolis in micewith collagen-induced arthritis[J].Inflammopharm-acology,2012,20(1):19-26.
[37] Massaro F C,Brooks P R,Wallace H M,et al.Cerumenof Australian stingless bees(Tetragonula carbonaria):Gas chromatography-mass spectrometry fingerprints andpotential anti-inflammatory properties[J].Naturwissen-schaften,2011,98(4):329-337.
[38] Nakajima Y,Shimazawa M,Mishima S,et al.Waterextract of propolis and its main constituents,caffeoylquinic acid derivatives,exert neuroprotectiveeffects via antioxidant actions[J].Life Sci,2007,80(4):370-377.
[39] 胡福良,李英华,朱威,等.不同方法提取的蜂胶液中总黄酮含量的测定及抗肿瘤与抗炎作用研究[J].中国食品学报,2005,5(3):11-15.
[40] Sa-Nunes A,Faccioli L H,Sforcin J M.Propolis:Lymphocyte proliferation and IFN-gamma production[J].J Ethnopharmacol,2003,87(1):93-97.
[41] Orsatti C L,Missima F,Pagliarone A C,et al.Propolisimmunomodulatory action in vivo on toll-like receptors 2and 4 expression and on pro-inflammatory cytokinesproduction in mice[J].Phytotherapy Res,2010,24(8):1141-1146.
[42] Steinhagen F,Kinjo T,Bode C,et al.TLR-based immuneadjuvants[J].Vaccine,2011,29(17):3341-3355.
[43] Mills K H G.TLR-dependent T cell activation inautoimmunity[J].Nat Rev Immunol,2011,11(12):807-822.
[44]Woo K J,Jeong Y J,Inoue H,et al.Chrysin suppresseslipopolysaccharide-induced cyclooxygenase-2 expressionthrough the inhibition of nuclear factor for IL-6(NF-IL6)DNA-binding activity[J].Febs Lett,2005,579(3):705-711.
[45] Raso G M,Meli R,Di Carlo G,et al.Inhibition ofinducible nitric oxide synthase and cyclooxygenase-2expression by flavonoids in macrophage J774A.1[J].Life Sci,2001,68(8):921-931.
[46] Borrelli F,Maffia P,Pinto L,et al.Phytochemicalcompounds involved in the anti-inflammatory effect ofpropolis extract[J].Fitoterapia,2002,73(Suppl 1):S53-S63.
[47] Cheng C Y,Ho T Y,Lee E J,et al.Ferulic acid reducescerebral infarct through its antioxidative and anti-inflammatory effects following transient focal cerebralischemia in rats[J].Am J Chin Med,2008,36(6):1105-1119.
[48] Hamalainen M,Nieminen R,Vuorela P,et al.Anti-inflammatory effects of flavonoids:genistein,kaempferol,quercetin,and daidzein inhibit STAT-1 andNF-kappa B activations,whereas flavone,isorhamnetin,naringenin,and pelargonidin inhibit only NF-kappa Bactivation along with their inhibitory effect on iNOSexpression and NO production in activated macrophages[J].Mediators Inflamm,2007,13:45673-45683.
[49] Wang L,Tu Y C,Lian T W,et al.Distinctive antioxidantand antiinflammatory effects of flavonols[J].J Agri FoodChem,2006,54(26):9798-9804.
[50] Beltran-Ramirez O,Perez R M,Sierra-Santoyo A,et al.Cancer prevention mediated by caffeic acid phenethylester involves cyp2b1/2 modulation in hepatocarcino-genesis[J].Toxicol Pathol,2012,40(3):466-472.
[51] Lin H P,Jiang S S,Chuu C P.Caffeic acid phenethyl estercauses p21 induction,Akt signaling reduction,and growthinhibition in PC-3 human prostate cancer cells[J].PLoSOne,2012,7(2):e31286.
[52] Aygun F O,Akcam F Z,Kaya O,et al.Caffeic acidphenethyl ester modulates gentamicin-induced oxidativenephrotoxicity in kidney of rats[J].Biol Trace ElementRes,2012,145(2):211-216.
[53] Yang Y H.Caffeic acid phenethyl ester possessing variousimmunomodulatory effects is a potentially effectivetherapy for asthma[J].Pediatrics Neonatol,2011,52(6):307-308.
[54] Gocer H,Gulcin I.Caffeic acid phenethyl ester(CAPE):Correlation of structure and antioxidant properties[J].IntJ Food Sci Nutrit,2011,62(8):821-825.
[55] Saavedra N,Barrientos L,Herrera C L,et al.Effect ofChilean propolis on cariogenic bacteria Lactobacillusfermentum[J].Ciencia E Investigacion Agraria,2011,38(1):117-125.
[56] Natarajan K,Singh S,Burke T R,et al.Caffeic acidphenethyl ester is a potent and specific inhibitor ofactivation of nuclear transcription factor NF-kappa B[J].Proceedings National Acad Sci,1996,93(17):9090-9095.
[57] Wang L C,Lin Y L,Liang Y C,et al.The effect of caffeicacid phenethyl ester on the functions of human monocyte-derived dendritic cells[J].BMC Immunol,2009,10:39-51.
[58] Wang L C,Chu K H,Liang Y C,et al.Caffeic acidphenethyl ester inhibits nuclear factor-kappa B andprotein kinase B signalling pathways and inducescaspase-3 expression in primary human CD4+T cells[J].Clin Exp Immunol,2010,160(2):223-232.
[59] 王凯,张翠平,胡福良.巴西绿蜂胶主要生物活性成分的研究进展[J].天然产物研究与开发,2013,25(1):140-145.
[60] Paulino N,Abreu S R L,Uto Y,et al.Anti-inflammatoryeffects of a bioavailable compound,artepillin C,inbrazilian propolis[J].Eur J Pharmacol,2008,587(1/3):296-301.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-