摘要:以蜂胶黄酮(PF)为免疫增强剂,探讨其对免疫雏鸡血清抗体效价和外周血T淋巴细胞增殖以及对培养的鸡脾脏淋巴细胞增殖的影响。结果表明:PF能显著提高雏鸡的血清抗体效价,促进外周血淋巴细胞增殖,且有一定的量效和时效关系;在体外,也能促进鸡脾脏T淋巴细胞增殖,以低浓度的效果较好。证明PF具有较强的增强免疫活性,是蜂胶中增强免疫作用的有效成分。
关键词:蜂胶黄酮;血清抗体效价;淋巴细胞增殖
蜂胶作为免疫增强剂已广泛用于畜禽传染病的预防[1]。然而临床多使用蜂胶醇溶物,由于其含有大量的杂质,且有效成分的含量不稳定,故在应用中存在制剂困难及临床效果不稳定等缺点。黄酮类化合物是蜂胶的主要活性成分[2],但尚未见有关蜂胶黄酮(PF)免疫药理作用的验证报道。本研究从蜂胶中提取PF,探讨PF的免疫效用,以期证实PF的增强免疫活性,为替代蜂胶粗提物、开发新型免疫增强剂提供理论依据。
1、材料与方法
1.1 主要试剂与仪器
PF由南京农业大学中兽医学研究室提取,用分光光度法测得黄酮净含量为569.2g·L-1;RPMI1640培养基(美国Gibco公司),按其说明用三蒸水配制后过滤除菌,分装后4℃保存,临用前加小牛血清(杭州四季青生物制品厂)达10%和常规量的双抗;伴刀豆素蛋白(ConA)和细菌脂多糖(LPS)(美国Sigma公司),用RPMI1640培养液配成0.025和0.25mg·mL-1溶液;四甲基偶氮唑蓝(MTT)(美国Amresco公司),用PBS液(pH7.4)配成5mg·mL-1的溶液,0.22μm微孔滤膜过滤,避光保存;淋巴细胞分离液(上海恒信化学试剂公司,批号为20001220);二甲亚砜(DMSO)为分析纯试剂。
CO2培养箱(美国Revco公司);XSZ-D2型倒置显微镜(重庆光学仪器厂);DG-3022型酶联免疫检测仪(华东电子管厂)。
1.2 PF对免疫雏鸡血清抗体效价的影响试验
取10日龄试验鸡(非免疫健康罗曼蛋公鸡)120羽,随机均分成PF高剂量组(PFH)、PF低剂量组(PFL)、疫苗对照组和空白对照组。除空白对照组外,各组同时于13日龄用NDVⅣ疫苗(中牧股份南京药械厂)点眼、滴鼻免疫,每羽接种4羽份剂量。14日龄起,高、低剂量组每羽分别皮下注射PF溶液(1mg·mL-1)1、0.5mL,疫苗对照组、空白对照组每羽注射生理盐水1mL,每天1次,连续3d。各组分别于20、27、34、41日龄时随机抽取10羽,翼静脉采血,分离血清,用U-微量法[3]检测血清HI抗体效价。数据用SPSS软件统计分析。
1.3 PF对雏鸡外周血T淋巴细胞增殖的影响试验
1)试验方法:取试验鸡60羽,从11日龄起,高、低剂量组每羽分别肌肉注射PF溶液(1mg·mL-1)1、0.5mL,对照组每羽注射0.5mL生理盐水,每天1次,连续3d。14日龄时各组均用4羽份剂量NDVⅣ疫苗点眼、滴鼻首免,28日龄用相同疫苗4羽份剂量肌肉注射二免。分别于35、42、49、56日龄每组随机抽取4只,无菌心脏采血,每只5mL,肝素钠抗凝,测定淋巴细胞增殖。
2)淋巴细胞增殖测定:用MTT法[4-6]测定。以570nm处的吸光值(D570nm)作为淋巴细胞增殖的指标。D值越大,表明活细胞数越多,细胞增殖越显著.
1.4 PF对培养的鸡脾脏淋巴细胞增殖的影响测定
取60日龄公鸡,颈静脉放血处死,无菌取出脾脏,用灭菌生理盐水冲洗3次,放入含Hank’s液的平皿中,剪碎,装入0.15mm筛孔的尼龙网袋中,用弯针头挤压过滤,收集细胞液,加入淋巴细胞分离液,2000r·min-1离心20min,吸取中间云雾状白细胞层,用Hank’s液洗2次,用RPMI1640营养液稀释成1×107个·mL-1细胞悬液。将细胞悬液分成3份,其中2份分别加入ConA(终浓度为5μg·mL-1)或LPS(终浓度为10μg·mL-1)。然后加入到96孔细胞培养板中,每孔加100μL,再分别加入用RPMI1640营养液稀释的各浓度PF100μL(完全在细胞安全浓度范围内),每种浓度重复4孔。ConA、LPS对照孔不加PF,同时设细胞对照孔。其余同1.3。
2、结果与分析
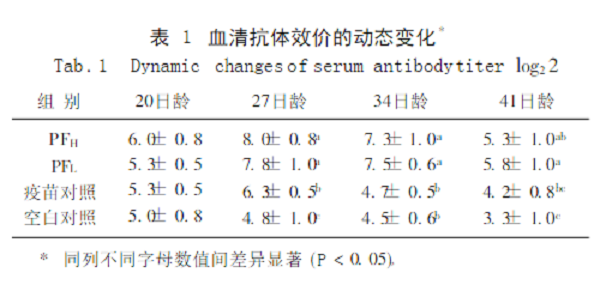
2.1 PF对雏鸡血清抗体效价的影响
由表1可见,PF的2个剂量组不同日龄的抗体效价均高于疫苗对照组和空白对照组,27日龄时显著高于2个对照组,34日龄时显著高于空白对照组,表明PF有促进抗体生成的作用。2个剂量组之间差异不显著。
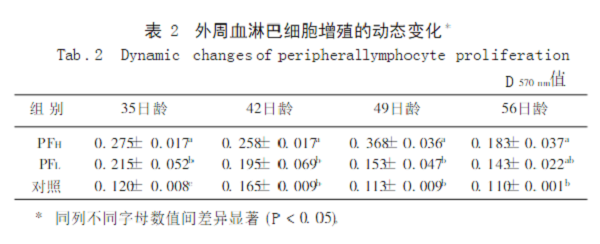
2.2 PF对雏鸡外周血淋巴细胞增殖的影响
由表2可见高剂量组不同日龄点的D值均显著大于对照组,低剂量组只在35日龄时显著大于对照组。表明PF能促进雏鸡外周血淋巴细胞增殖,且其作用随用药剂量及时间而改变。
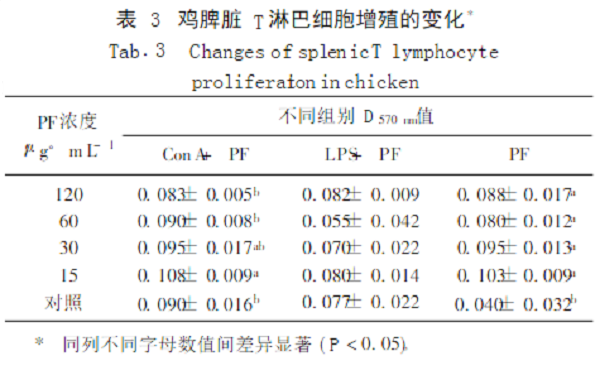
2.3 PF对培养的鸡脾脏T淋巴细胞增殖的影响
由表3可见,PF各浓度组的D值均显著高于对照组,且呈浓度越高D值越小的趋势,与同浓度的ConA+ PF组、LPS+ PF组无显著差异;15μg·mL-1组显著大于ConA对照组及60、120μg·mL-1组。提示PF既能单独也能协同ConA刺激T淋巴细胞的增殖,低浓度的效果较好。
3、讨论
<p蜂胶能增强机体的特异性和非特异性免疫功能,具有增强小鼠抗体生成细胞及促进和调节机体体液免疫功能的作用[7]。蜂胶乙醇提取液还能增强ConA诱导的小鼠脾淋巴细胞增殖作用[8]。因此,蜂胶的增强免疫作用在已有的研究中被证实,但其增强免疫的有效成分尚未确定。虽然有人推测蜂胶中黄酮类成分与免疫有关[9],但未见验证报道。本研究结果表明,PF能促进免疫雏鸡抗体生成和外周血淋巴细胞增殖,促进体外培养的鸡脾脏T淋巴细胞增殖,且有一定的量效和时效关系。由此可以证实PF是蜂胶增强免疫作用的有效成分。
PF含有多种黄酮类化合物[2,10]。黄酮类化合物是自然界中一类重要的有生物活性的物质,种类繁多,功效各异。体外试验结果显示,在不加丝裂原的条件下,PF就能促进淋巴细胞增殖,具有丝裂原样作用;低浓度的PF能协同ConA刺激T淋巴细胞的增殖,高浓度的作用反而不明显,再次证实了其量效关系。而作为PF中组成成分的槲皮素、福橘黄素却具有抑制丝裂原(如PHA、ConA)的致有丝分裂作用[9]。由此说明天然组合而成的混合物——PF具有与各单体成分不完全一致的药效,这种药效是由多种单体成分产生的综合效应。因此,PF的药理效用必须经过试验验证,而不可根据其组成的各单体成分的功效简单推测。本研究首次利用从蜂胶中提取的PF并通过免疫试验证实其具有增强免疫的作用,而对PF的其他药理作用则需要作进一步的验证。
大量报道中使用的蜂胶制剂多为蜂胶醇溶物,由于其中含有大量树脂类等无免疫活性的杂质成分,这些杂质分子量大、水溶性差,给制剂应用带来不便,即使勉强制备成溶液或混悬液,也会因受热和久置而产生沉淀或结块现象,显然不符合注射用制剂的要求。同时因蜂胶的产地、收获季节或生产批次不一,而使蜂胶中活性成分的含量不稳定,这必将导致粗提物制剂增强免疫的效果不稳定。因此,提取并应用蜂胶中的有效成分,既能保证药效又有利于制剂的稳定。
参考文献:
[1] 吕殿红,宋大鲁.蜂胶在兽医上的应用[J].山东中兽医,1997(1):21-26.
[2] 叶陆星,胡福良.蜂胶中黄酮类化合物的生物学活性[J].养蜂科技,2002(2):9-11.
[3] 徐为燕.兽医病毒学[M].北京:农业出版社,1998:199-209.
[4] Ota B,Vera B,Frank W P. Optimum conditions for the chicken ly mphocy te transfo rmation test [J]. Avian diseases, 1992, 36: 945-955.
[5] Reynolds D L ,Maraqa A D . Protective immunity against newcastle disease: The role cell-m ediated immunity [J]. Avian Diseases, 2000, 44: 145-154.
[6] 李祥瑞,金红,王秀丽,等.以MTT比色法检测鸡脾淋巴细胞转化效果[J].畜牧与兽医,1996,28(1):3-5.
[7] 于晓红,李淑华,李树伟,等.蜂胶对小鼠免疫功能影响的实验研究[J].中医药信息,2001,18(4):53-54.
[8] 李淑华,于晓红,于英君,等.蜂胶对免疫功能低下模型鼠细胞免疫功能的影响[J].中医药学报,2001,29(3):38-39.
[9] 彭增起,牛文娟,常彦红.蜂胶中的类黄酮及类黄酮的保健作用[J].中国养蜂,1996(4):14-15.
[10] V assy a S, Bankov a V. Propolis : Recent adva nces in chemist ry and plant origin[J]. Apido logie, 2000, 31 : 3-15.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-