摘要:蜂胶对脑缺血再灌注损伤具有显著的神经保护作用,国内外学者已经对此展开了广泛而深入的研究。本文对脑缺血再灌注损伤的机理,现有实验模型和蜂胶对缺血再灌注损伤的作用效果及作用机理进行了综述,并对今后的研究重点进行了展望。
王馨 徐响 俞斌 孙丽萍(中国农业科学院蜜蜂研究所,北京 100093;农业部授粉昆虫生物学重点实验室,北京 100093)
关键词:蜂胶;脑缺血再灌注;作用机制
蜂胶是蜜蜂从胶源植物的树芽、树皮等部位采集的树脂,并混入其上颚腺的分泌物和蜂蜡,经蜜蜂反复咀嚼代谢而合成的一种胶状物质[1]。蜂胶中含有丰富的萜烯类,酚类,黄酮类等生物活性物质,具有抗癌,抑菌,抗炎,抗氧化,保肝,护脑等丰富的药理活性,近年来成为国内外的研究热点[2-4]。
脑血管疾病是常见的临床的多发病,为目前三大致死疾病之一,其致残率、致死率均呈逐年上升的趋势[5]。其中,由缺血引起的脑组织损伤是脑卒中、脑梗塞等致死性疾病的主要原因,其治疗原则为尽快恢复缺血区的血流供应。然而,在目前对脑缺血性疾病的治疗和研究中发现,恢复脑缺血部分的血流供应以后,缺血性损伤反而进一步加重,这种现象即脑缺血再灌注损伤(Ischemia Reperfusion Injury, IRI),其损伤机制十分复杂。
1 脑缺血再灌注的损伤机制及实验模型
缺血再灌注损伤是一个非常复杂的病理生理过程,主要包括缺血期的原发性损伤和再灌注期的继发性损伤[6]。由缺氧缺血所造成的能量代谢障碍为其发病基础,再灌注时由能量代谢障碍引发的钙离子超载,氧自由基(ROS)损伤和兴奋性氨基酸的毒性作用及炎性细胞因子损伤以及细胞凋亡通路的激活等各种因素和环节互为因果、相互影响,共同导致了细胞的损伤、凋亡和死亡[7-8]。
1.1 脑缺血再灌注损伤的机制研究进展 目前研究认为缺血再灌注损伤致神经元死亡的分子机制如下图所示。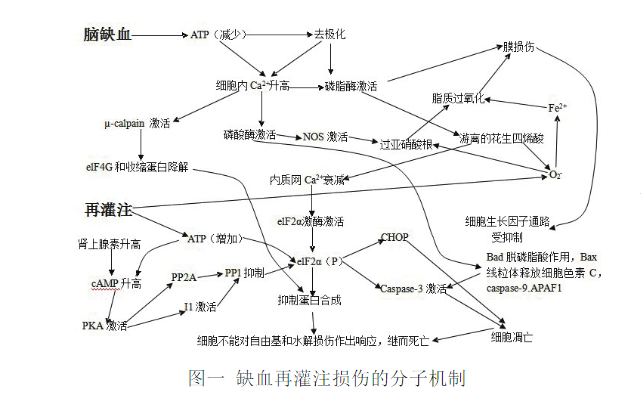
如图一所示,缺血性的能量衰减通过打开神经递质的通路,膜去极化和泵的活性降低导致神经元钙超载。细胞质内的钙超载激活了包括钙激活酶(µ-calpain),钙调磷酸酶,磷脂酶A2在内的酶类;磷脂酶通过膜去极化直接被激活。细胞支架蛋白和真核翻译起始因子eIF4G被µ-calpain分解。磷酸酶的脱磷酸作用激活了一氧化氮合酶(NOS),并且从螯合蛋白中解离出Bad(Bcl-xl/Bcl-2 associated death promoter)。磷脂酶水解出游离脂肪酸,特别是从细胞膜上水解出花生四烯酸。花生四烯酸引起内质网Ca2+的降低,从而诱导内质网未折叠蛋白激活eIF2α激酶。再灌注过程中,伴随着花生四烯酸的新陈代谢和氧自由基诱导一氧化氮(NO)的生成,过氧化物也随之产生,这些因素共同通过脂质过氧化反应造成了膜损伤。蛋白激酶A(PKA)通过肾上腺素信号通路抑制了蛋白磷酸酶1(PP1)的活性。除此之外,eIF2α激酶的上调和蛋白磷酸酶1(PP1)的下调共同导致了后磷酸化真核细胞起始因子2α[eIF2α(P)]急速升高20倍,这个反应抑制了蛋氨酸起始密码子进行肽合成反应。eIF2α(P)同过一些未知的机制进行CHOP(C/EPB同源蛋白)转录和caspase-3激活。脂质过氧化反应抑制了凋亡抑制因子的信号通路。磷酸化的Bad与Bcl-2相结合,随之释放Bax,这步反应诱导线粒体释放细胞色素C并且诱导caspase-9与凋亡酶激活因子(APAF1)相互作用,从而激活caspase-3,诱发细胞凋亡。细胞在此时不能对水解损伤和自由基损伤作出响应,继而死亡[5,9-10]。
缺血后兴奋性氨基酸(Excitatory Amino Acid, EAA)的兴奋性毒性升高。EAA是一种神经递质,在神经系统中主要是指谷氨酸(Glu)和天冬氨酸(Asp),其可导致Ca2+超载,从而介导N-甲基-D-门冬氨酸(NMDA)受体的过度刺激引发细胞坏死[11]。其次,EAA会造成大量的Na+、Cl-和H2O内流,造成神经元细胞的毒性水肿。EAA还可导致氧自由基(如NO、O2-)的生成增多,从而加重细胞毒性水肿,导致细胞结构解体,诱发细胞发生凋亡[6]。
1.2 国内外脑缺血再灌注损伤的实验模型概述
针对脑缺血再灌注的损伤机制,目前国内外广泛采用的体外模型可分为以下两种:能量缺乏性损伤和化学性损伤。能量缺乏损伤剥夺能量的方式主要是通过物理或化学方法给予神经细胞缺糖或缺氧等培养条件。可采用三气培养箱(95%N2,5%CO2和2%O2)造成低氧环境同时配合无糖培养基,造成氧糖剥夺(Oxygen and Glucose Deprivation,OGD)模型[6],模拟体内缺血再灌注损伤;也可使用连二亚硫酸钠作为除氧剂造成细胞无氧生长环境[12]。有研究表明,2mmol/L的连二亚硫酸钠可迅速清除培养基中的氧气,不会改变培养基pH且不损伤 细胞膜[12-13]。化学性损伤即向培养基中添加化学致伤物,如N-甲基-D-门冬氨酸,谷氨酸及活性氧自由基 等[6],模拟体内缺血再灌注损伤。目前,国内外多采用H2O2诱导细胞损伤[14],可采用100 µMH2O2诱导原代培养的皮层神经元损伤,从活性氧自由基的角度模拟缺血再灌注损伤[15]。
2 蜂胶抗缺血再灌注损伤的研究进展
近年来从天然产物中寻找抗缺血再灌注损伤活性因子已成为一大研究热点,迄今为止,蜂胶抗脑缺血再灌注损伤的活性作用及机制的研究也取得了一系列的成果。
2.1 蜂胶提取物抗缺血再灌注损伤的作用及其机制
蜂胶乙醇提取物(EEP)可以舒张血管,改善血管的渗透性和弹性,能清除血管内壁积存物[16],具有清除自由基、抗氧化和抗缺血再灌注损伤作用[17]。 以30-100mg/kg的巴西绿蜂胶饲喂成年小鼠,可缩减脑缺血后的脑梗死体积,减轻脑组织水肿并降低神经功能缺陷[18],巴西绿蜂胶的乙醇和水的提取物均对超氧阴离子自由基和羟基自由基等活性氧簇具有清除作用[19]; 但巴西蜂胶的水提物较醇提物可以更有效的减少神经元细胞中ROS的生成,可能与其富含更多单咖啡酰奎宁酸和二咖啡酰奎宁酸有关[20]。葡萄牙东北部蜂胶的乙醇提取物(EEP)可以减少神经元中H2O2诱导生成的ROS量,并抑制caspase-3的激活,从而对皮层神经元具有保护作用[15] 。蜂胶可显著抑制H2O2诱导的PC12细胞的神经毒 性,其作用机制与其抑制神经元细胞的脂质过氧化反应和清除DPPH诱导的自由基反应有关[18]。蜂胶黄酮可以通过增加SOD、CAT活性,降低MDA含量,增强对自由基的清除作用从而保护神经细胞膜的完整性和稳定性[21];且通过抑制炎症因子IL-1β、TNF-α、IL-6的表达抑制再灌注后的炎症反应,缩小脑梗死体积,从而对缺血性损伤具有保护作用[22];能促进bcl-2 表达增强,减弱bax与caspase-3表达,因此能有效减少脑缺血再灌注损伤引起的神经细胞凋亡[23]。杨树胶提取物可抑制星状孢菌素(STS )诱导的皮层神经元中Caspase-3激活,进一步抑制细胞凋亡从而对神经元具有保护作用[24]。
2.2 蜂胶活性组分抗缺血再灌注损伤的作用及其机制
蜂胶的化学组成复杂,主要包括近50%的树脂(酚类成分,主要包括黄酮和酚酸),30%的蜂蜡(蜡和脂肪酸),10%的芳香油,5%的花粉及5%的其他物质(有机物和矿物质)。蜂胶中含有丰富的酚类物质,主要为黄酮、酚酸及其酯类物质[25]。目前,多酚类物质被公认为蜂胶中的药理学有效物质[26]。
松属素和白杨素是蜂胶中含量较多的黄酮类物质,二者的含量均为2%-4%[27],均能抑制Caspase-3 及其上游通路的激活,从而抑制H2O2诱导的SH-SY5Y细胞凋亡[14-30],对脑缺血再灌注损伤具有神经保护作用。松属素可明显增加动脉栓塞大鼠的存活率,减小脑梗死体积,降低神经行为学评分[28];其作用机制主要与降低ROS和NO的生成,抑制 caspase-3的激活等有关,对体外模拟的皮层神经元缺血性损伤具有神经保护作用[29] 。
咖啡酸苯乙酯(CAFE)是蜂胶中的主要组分,具有极为广泛的药理活性。CAFE通过其抗氧化活性可以保护大鼠和兔脑的局部永久缺血性损伤[31-32];可作为一种有效的缺氧诱导因子(HIF)脯胺酰羟化酶抑制剂作用于HIF通路上[33],通过抑制p38的磷酸化作用和capase-3的激活来降低谷氨酸诱导的神经元细胞毒性[34],对脑缺血再灌注损伤具有保护作用。
3 结语
蜂胶富含多种活性成分,具有丰富的药理活性,其抗脑缺血再灌注损伤的活性及机理已成为国内外的研究热点。然而,目前的相关活性研究多停留在蜂胶提取物的层面上,因此,系统确定蜂胶提取物中保护神经元的活性组分,以及评估活性化合物之间可能存在的协同作用或拮抗作用将是今后的研究重点。
参考文献:
[1]王储炎,范涛,吴传华,等.蜂胶的研究[J],农产品加工,2009,(1),16-21.
[2]Ugur A,Arslan T(2004)An in vitro study on antimicrobial activity of propolis from Mugla province of Turkey.Med Food,7,90-4.
[3]杜夏,孙丽萍,徐响,蜂胶及活性成分保肝作用的研究进展,食品科学,2012(33):305-308.
[4]Bankova V.Recent trends and important development in propolis research[J].Evidence-based Complementary and Alternative Medicine,2005,2(1):29-32.
[5]Blaine C.White,Jonathon M.Sullivan,Donald J.DeGracia.Brain ischemia and reperfusion:molecular mechanisms of neuronal injury[J].Journal of the Neurological Sciences,2000,179,1-33.
[6]韩敏,刘艳凯,薛茜.脑缺血再灌注损伤的研究进展[J].河北北方学院学报,2006,23(5),75-78.
[7]Shinoura R,Satou R,Yoshida Y,et al.Adenovirus-mediated transfer of Bcl-X(L)protects neuronal cells from Bax-induced apoptosis.Exp Cell Res,2000,254:221-231.
[8]Krause GS,White BC,Aust GW,et al.Brain cell death following ischemia and reperfusion:a proposed biochemical sequence.Crit Care Med,1988,16,714-26.
[9]T Farooqui,AA Farooqui.Aging:an important factor for the pathogenesis of neurodegenerative diseases[J].Mech Ageing Dev,2009(130),203-15.
[10]AA Farooqui.Neurochemical Aspects of Neurotraumatic and Neurodegenerative Disease.Springer New York,2010.
[11]Nakayama R,Yano T,Ushijima K,et al.Effects of dantrolene on extracellar glutamate concentration and neuronal death on the rat hippocampal CAI region subjected to transient ischemia[J].Anesthesiology,2002,96(3):705-710.
[12]刘娜,左萍萍,周帆,等.连二亚硫酸钠致PC12和NG108-15细胞拟缺血再灌注损伤研究[J].中国药理学通报,1998,14(6):525-529.
[13]马殿伟,谢学军,李晓微.缺氧实验模型研究进展[J].临床医学,2007,23(13):1795-1798.
[14]Sam Sik Kang,Ji Yeon Lee,Yoo Keum Choi,et al.Neuroprotective effects of flavones on hydrogen peroxide-induced apoptosis in SHSY5Y neuroblostoma cells[J].Biooroganic&Medicinal Chemistry Letters,2004,14:2261-2264.
[15]Susana M.Cardoso,Marcio Ribeiro,IIdete L,et al.Northeast Portuguese propolis protects against staurosporine and hydrogen peroxide-induced neurotoxicity in primary cortical neurons[J].Food and Chemical Toxicology,2011,49:2862-2868.
[16]Castaldo S,Capasso F.Propolis,an old remedy used in modern medicine[J].Fitoterapia,2002,73(Supp11):1-6.
[17]孔庆峰,许志文,邓玉文.国内蜂胶黄酮的药理学研究近况[J].实用医药杂志,2006,8(1):23.
[18]Masamitsu Shimazawa,Satomi Chikamastu,Nobutaka Morimoto,et al.Neuroprotection by Brazilian Green Propolis agains in vitro and in vivo Ischemic Neuronal Damage[J].eCAM,2005,2(2):201-207.
[19]Nakamura-Lopez,Y.,Sarmiento-Silva,R.E.,Moran-Andrade,J.,et al.Staturosporine-induced apoptosis in P388D1 macrophages invovles both extrinsic and intrinsic pathways[J].Cell Biol,2009(33):1026-1031.
[20]Inokuchi,Y.,Shimazawa,M.,Nakajima,Y.,et al.Brazilian Green Propolis protects against retinal danage in vitro and in vivo[J].Evid.Based complement.Alternat.Med.3,71-77.
[21]袁丽杰,赵蕾,张悦,等.蜂胶黄酮对大鼠脑缺血再灌注损伤的保护作用[J].中国老年医学杂志,2010,8(30):2187-2188.
[22]袁丽杰,赵蕾,凌春莹,等.蜂胶黄酮对大鼠脑缺血再灌注损伤后IL-1β、IL-6和TNF-α含量的影响[J].中国比较医学杂志,2008,8(18):11-14.
[23]覃燕飞,毕丹东,蜂胶总黄酮对大鼠缺血再灌注后大脑皮质神经细胞凋亡和caspase-3与bcl-2及bax表达的影响[J].中华临床医师杂志,2010,4(7):1023-1027.
[24]Izuta,H.,Shimazawa,M.,Tazawa,S.,et al.Protective effects of Chinese propolis and its component,chrysin,against neuronal cell death via inhibition of mitochondrial apoptosis pathway in SH-SY5Y cells.J Agric.Food Chem,2008(56):8944-8953.
[25]Tahira Farooqui,Akhiaq A.Farooqui.Beneficial effects of propolis on human health and neurological diseases[J].Frontiers in Bioscience,2012,1:779-793.
[26]BH Havsteen.The biochemistry and medical significance of the flavonoids[J].Pharmacol Ther,2002(96):67-202.
[27]Cuesta-Rubio O,Piccinelli A L,Fernandez M C,et al.Chemical characterization of Cuban propolis by HPLC-PDA,HPLC-MS,and NMR:the Brown,Red,and Yellow Cuban varieties of propolis.Journal of Agricultural and Food Chemistry,2007,55(18):7502-7509.
[28]Rui Liu,Mei Gao,Zhi-Hong Yang,et al.Pinocembrin protects rat brain against oxidation and apoptosis induced by ischemia-reperfusion both in vivo and in vitro[J].Brain research,2008(1216):104-115.
[29]Guang,H.M.,Du,G.H.Protections of pinocembrin on brain mitochondria contribute to cognitive improvement in chronic cerebral hypoperfused rat[J].Eur J Pharmacol,2006(542):77-83.
[30]Gao,M.,Zhang,W.-C.,Liu,Q.-S.,et al.Pinocembrin prevents glutamate-induced apoptosis in SH-SY5Y neuronal cells via decrease of bax/bcl-2 ratio.Eur.J.Pharmacol.,2008(591):73-79.
[31]SK Tsai,MJ Lin,PH Liao,et al.Caffeic acid phenethyl ester ameliorates cerebral infarction in rats subjected to focal cerebral ischemia[J].Life Sci,2006(78):2758-62.
[32]ME Altu?,Y Serarslan,R Bal,et al.Caffeic acid phenethyl ester protects rabbit brains against permanent focal ischemia by antioxidant action:a biochemical and planimetric study[J].Brain Res,2008(1201):135-42.
[33]D Choi,J Han,Y Lee,et al.Caffeic acid phenethyl ester is a potent inhibitor of HIF prolyl hydroxylase:structural analysis and pharmacological implication[J].J Nutr Biochem,2010(21):809-17.
[34]X Wei,Z Ma,CV Fontanilla,er al.Caffeic acid phenethyl ester prevents cerebellar granule neurons(CGNs)against glutamateinduced neurotoxicity[J].Neuroscience,2008(155):1098-10105.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-




