【摘要】目的:观察蜂胶干预后小鼠血浆、肝脏、粪便、肾上腺中3H-胆固醇的分布和血浆脂质水平的变化,探讨蜂胶对小鼠体内胆固醇逆转运的影响。方法:14只C57BL/6小鼠随机分为对照组和蜂胶组,分别给予单纯溶剂和蜂胶灌胃4周后,腹腔注射经乙酰化低密度脂蛋白及3H-胆固醇处理过的小鼠巨噬细胞悬液,单独笼养48h,取血,留置肝脏和肾上腺,收集粪便。酶法测定血浆脂质水平;经液体闪烁计数测定血浆、肝脏、粪便、肾上腺中的3H-胆固醇含量。结果:与对照组相比,蜂胶升高血浆高密度脂蛋白胆固醇和总胆固醇水平分别为39%和29%,对低密度脂蛋白-胆固醇和甘油三酯的水平影响不大;注入细胞后血浆3H-胆固醇分布明显的迅速增高,6h为对照组2.9倍,24h为对照组1.7倍;肝脏中3H-胆固醇分布降低了39%;粪便中的3H-胆固醇分布降低了60%;而小鼠肾上腺中3H-胆固醇的分布升高了84%。结论:蜂胶在体内促进了外周巨噬细胞中多余的胆固醇的流出和肾上腺组织的利用。
【作者】 司艳红 于杨 王欣农 桑慧 王绍燕 王家富 秦树存
【关键词】胆固醇逆转运 蜂胶 小鼠
随着降脂药的不断更新,人体低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDLC)水平已经降到自然状态的低极限,即使这样,降脂药物也只能降低25%~40%的心血管病事件,仍然有60%~75%的事件不能单纯靠降低LDLC来预防。胆固醇逆转运是机体排出过多胆固醇的唯一途径,也是目前认为机体内对抗动脉粥样硬化(atherosclerosis,As)发生的主要机制之一。因此,胆固醇逆转运开始受到重视,成为新的研究靶点。
蜂胶含有多种活性成分,包括黄酮类化合物,萜烯类物质,有机酸类,芳香性醛类,醇类,脂类以及多种氨基酸,维生素,微量元素等,具有多种生物学活性。近年来,蜂胶对心血管疾患的防治不断受到人们重视。已有实验证实蜂胶能降低高脂血症动物TC和LDLC[1],对家兔动脉粥样硬化斑块的发生发展有预防作用[2],但其发生机制尚未阐述清楚。本研究观察蜂胶对小鼠体内胆固醇逆转运的影响。
1 材料和方法
1.1 材料
14只8月龄健康雄性C57BL/6小鼠(SPF级,30~35g)购自北京大学医学院实验动物中心,在泰山医学院实验动物中心饲养;泰山柏树粗蜂胶购自泰山虎山养蜂厂;细胞株raw264.7购自中国科学院上海细胞库;3H-胆固醇购自Perkin E lmer;超速冷冻离心机购自美国BECKMAN-COUNTER公司,型号Optima LE-80K;液闪计数仪为国产SN-6930B型;Speed Vac真空离心浓缩仪购自Thermo electroncorporayion,型号SPD-1010;DMEM培养基购自hy-clone,新生牛血清购自杭州四季青生物工程材料有限公司。
1.2 蜂胶乙醇浸膏的制备
泰山粗蜂胶煮沸,冷却后去蜡制成精制蜂胶。将精制蜂胶冷冻并粉碎,与75%的乙醇按固液比1∶4浸泡过夜,30℃恒温超声30min,静止1h,再30℃恒温超声30min,静止2h,过滤。收集滤液后经旋转蒸发仪减压浓缩,得蜂胶乙醇浸膏,经测定其总黄酮的含量为28.65%。
1.3 动物干预
C57BL/6小鼠14只随机分为对照组和蜂胶组,实验前每组血浆总胆固醇水平相似,差异无显著性。两组均为普通饲料饲养,自由饮水。蜂胶组把蜂胶乙醇浸膏溶于0.05mL蜂蜜中灌胃,剂量为160mg/kg,每天一次;对照组每天灌胃0.05mL纯蜂蜜。喂养4周后,给小鼠腹腔注射制备好的细胞悬液(0.5mL/鼠),单独笼养48h后处死小鼠,进行相关检测。
1.4 低密度脂蛋白的提取
密度梯度超速离心法提取LDL,将新鲜血放于抗凝管中,离心10min(2.5kr/min,4℃),收集血浆。根据公式X=V(d2-d1)/(1-ud2)用NaBr配制1.063与1.019的密度液,并调节血浆密度至1.200。依次缓慢铺入密度液(密度为1.200的血浆8mL,1.063的密度液8mL;1.019的密度液8mL),用Type70 Ti转头,在4℃、50kr/min离心10h。为避免扰动梯度界面,采用慢加速程序启动,慢减速程序停机。经琼脂糖凝胶电泳检测LDL的纯度,经BCA法测定蛋白浓度为1.6g/L。
1.5 低密度脂蛋白的乙酰化
将提取的LDL浓缩至5g/L后,用无EDTA的生理盐水在4℃透析24h,去除EDTA.在冰浴并不断搅拌下,首先在含有1mL LDL(5mg)的试管内加入1mL饱和醋酸钠,然后把醋酸酐7.5mg(相当于LDL蛋白量的1.5倍)以小液滴(2μL/滴)的形式于30min内全量加入,加入后混合液继续搅拌30min。将混合液装入透析袋,在4℃下透析24h(透析液配方为0.15mol/L NaC l,O.3mmol/L EDTA,pH7.4)终止乙酰化。测得TBARS值为1.415,琼脂糖凝胶电泳迁移率增加了1倍,表明LDL已经乙酰化。
1.6 细胞培养及干预
Raw264.7细胞在含有10%新生牛血清(NBS)的DMEM液中培养。细胞传代时调整细胞浓度为5×108个/L,接种于培养瓶,于37℃、5%CO2培养箱中静置培养。将制备好的ac-LDL和相应的3H-胆固醇在37℃共孵育30min后加入到含1%NBS的DMEM中,使ac-LDL终浓度为200mg/mL,3H-胆固醇终浓度5mC i/L。细胞干预:将制备好的干预液加至上述已培养24h的细胞中,再于37℃、5%CO2培养箱中静置培养24h。
收获干预好的细胞,胰酶消化离心后加入预冷的PBS冲洗2遍,1kr/min离心2min,将细胞悬浮于PBS中,调整细胞数为1.2×1010个/L后,放置于冰上备用。吸取100μL细胞悬液3次,分别置于3个EP管中,离心后,各吸取10μL上清,用液闪记数仪记数。吸除剩余上清,加入200μL正己烷/异丙醇(3∶2),混匀,离心,吸取有机相进行真空干燥(重复抽提两遍),进行液体闪烁计数(liquid scintil-lation counting,LSC),计算出细胞内和上清液记数的平均比例,细胞内应>95%。
1.7 指标的检测
动物注射细胞前通过内眦静脉取血100μL,离心取血浆,试剂盒检测TC、TG、LDLC、HDLC。血液中的放射活性:动物于注入细胞后6、24、48h内眦静脉取血并离心(2.5kr/min,10min),取20μL血浆,加入闪烁液10mL,进行LSC。肝脏和肾上腺中的放射活性[3],48h后处死小鼠,取肝脏组织和两侧肾上腺用冷生理盐水冲洗后,滤纸吸干,称重,-20℃保存。取肝脏组织和两侧肾上腺匀浆后,用正己烷/异丙醇3∶2(vol/vol)萃取(重复3次),脂质层被收集,用真空冷冻干燥机浓缩,进行LSC。粪便中的放射活性[4],48h内的粪便称重,在4℃超纯水中浸泡过夜(1g/10mL),第二天加入等量乙醇,样品匀浆后取200μL,进行LSC。
1.8 统计学分析
所有数据经SPSS12.0统计软件包进行统计分析,对主要指标进行正态性检验,采用t-test来进行组间比较,P<0.05为差异有显著性。
2 结果
2.1 蜂胶干预后小鼠血浆3H-胆固醇分布
实验中分别测定小鼠注入细胞后6、24、48h血浆中的3H-胆固醇含量(占注射总量的百分比)。与对照组比较,蜂胶组小鼠血浆中3H-胆固醇的分布在6h与24h明显升高(P(0.01;表1),分别是对照组2.9倍和1.7倍。48h组差异无显著性。
表1.蜂胶干预后小鼠血浆的3H-胆固醇分布(x±s,cpm%)

2.2 蜂胶干预后小鼠肝脏、粪便、肾上腺的3H-胆固醇分布
实验测定了小鼠注入细胞48h后肝脏中剩余的3H-胆固醇含量、48h内收集的粪便中的3H-胆固醇含量和肾上腺中3H-胆固醇含量(占注射总量的百分比)。与对照组比较,蜂胶组小鼠肝脏中剩余的3H-胆固醇的含量降低了39%(P<0.01);两天中粪便排除的3H-胆固醇降低了60%(P<0.01);而肾上腺中3H-胆固醇分布却明显增多,升高了84%(P<0.01;表2)。
表2.蜂胶干预后小鼠肝脏、粪便、肾上腺的3H-胆固醇分布(x±s,cpm%)

2.3 蜂胶干预后小鼠的血脂变化
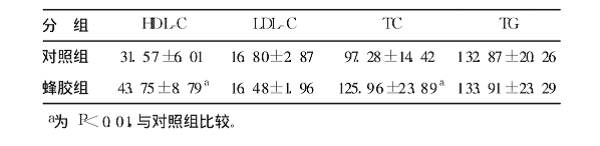
蜂胶干预4周后,与对照组比较,血浆高密度脂蛋白-胆固醇(HDLC)和总胆固醇(TC)的水平明显升高(P<0.05),升高幅度分别为39%和29%;血浆低密度脂蛋白胆固醇(LDLC)和甘油三酯(TG)水平变化不大(表3)。
表3.蜂胶干预后小鼠的血脂变化(x±s,mg/dL)
2.3 蜂胶干预后小鼠肝重、体重和肝重指数的变化
蜂胶干预4周后,与对照组比较,小鼠肝重、体重及肝重指数差异均无显著性,但是肝重及肝重指数有增高趋势(表4)。
表4.蜂胶干预后小鼠肝重、体重和肝重指数的变化(x±s,n=7)

3 讨论
胆固醇逆转运是指HDL将胆固醇从外周组织转运到肝脏进行再循环或以胆酸的形式排出体外的过程,包括胆固醇的流出、酯化及清除三个环节。首先外周细胞内多余的胆固醇经转运体(ABCA1、ABCG1或SR-BⅠ)的介导流出,呈递给HDL,在卵磷脂胆固醇酰基转移酶(lecithin-cholesterol acyl-transferase,LCAT)的催化下胆固醇酯化,使HDL核心胆固醇酯含量逐步增加,新生的HDL转变为成熟的HDL。肝脏可以通过其表面SR-BI受体接受HDL中的胆固醇,并进一步合成胆汁酸进行肝肠循环,小部分胆汁酸可以随粪便排除体外。此外,类固醇源性组织如肾上腺、睾丸和卵巢也可通过其表面受体SR-B1接受HDL中的胆固醇作为合成类固醇激素的原料[5]。自从1973年Gomset等[6]第一次提出这个概念后,此途径作为消退动脉粥样硬化的治疗策略靶点受到越来越多地重视。本研究借鉴Zhang等[7]和Naik等[4]建立的3H-胆固醇标记巨噬细胞后检测不同部位氚的放射活性的方法准确测定了体内胆固醇逆转运的效率,结果可信。
从小鼠血浆3H-胆固醇的检测结果来看,把含3H-胆固醇的巨噬细胞注入腹腔后蜂胶组血浆3H-胆固醇的含量迅速升高,6h达到了对照组的2.9倍,24h为对照组的1.7倍,而48 h时基本持平。这说明蜂胶干预后腹腔中注入的过多胆固醇流出并呈递给血浆HDL的能力增强。同时,从小鼠血脂变化来看,蜂胶组HDL的水平明显增加。现已确认HDL与冠心病的发生率呈负相关[8],最为重要的原因就是它能促进外周细胞中多余胆固醇逆向转运,最终或由粪便排除体外或被机体利用[9]。另外,本研究所已有实验数据证实蜂胶能够使小鼠自身腹腔巨噬细胞表达ABCA1和ABCG1明显增加。ABCA1介导了细胞内胆固醇和磷脂的流出及HDL2的形成[10],而ABCG1介导了细胞内胆固醇流向脂质丰富的HDL[11]。综合以上三方面原因,可以推断本实验中蜂胶促进了小鼠体内外周组织中多余胆固醇的流出。
与以往大多数体内胆固醇逆转运结果不一致,本实验中虽然蜂胶组小鼠血浆中3H-胆固醇含量明显升高,但肝脏和粪便中3H-胆固醇水平却明显降低,可能的原因考虑以下两个方面:第一,蜂胶组小鼠肝重指数有增大趋势,同时实验中也发现蜂胶组小鼠肝脏萃取的胆固醇偏多;另一方面,对小鼠的实验操作(如取血)可能会引起小鼠应激反应,使合成类固醇激素的器官对胆固醇的需求量增多。故蜂胶组血液中3H-胆固醇运输到肝脏可能会减少,而运输到肾上腺等组织增多。实验中转运至肾上腺的3H-胆固醇的确增多,说明蜂胶组小鼠肾上腺组织利用外周多余胆固醇的能力升高。对照组由于肝脏自身合成胆固醇少,故血液中3H-胆固醇转运至肝脏偏多。第二,有可能进入蜂胶组肝脏中的胆固醇分泌入胆汁中进行肝肠循环,未随粪便排除体外,但是本实验未监测胆汁中3H-胆固醇的水平,这也是本实验的不足之处。这个结果与2001年A lam等对apoAI-phospholipid复合物(rHDL)对胆固醇逆转运的研究结果相似:rHDL的快速输入能够动员外周组织中的胆固醇,减少As斑块,但是粪便中中性胆固醇和胆汁酸排除却没有增多,而是轻度降低趋势[12]。2008年Duffy等[9]也提出:巨噬细胞中胆固醇流出增加被重新分布到其他组织而没有随粪便排除增多,仍然可以认为对As有抑制作用。
在小鼠血脂检测结果中,蜂胶组血浆HDLC和TC均明显升高,通常升高血浆中胆固醇水平被认为是促进As发生发展的因素。但在本实验条件下,小鼠没有发生高脂血症,不会诱发As。同时小鼠脂蛋白主要是HDLC,TC升高的重要原因是HDLC这种胆固醇的增加,而LDLC及TG则没有升高。
总之,蜂胶可以升高野生型小鼠血浆HDLC的水平,在体内促进了外周巨噬细胞中多余的胆固醇的流出和肾上腺组织的利用。
参考文献:
[1] 胡福良,詹耀锋,陈民利,等.蜂胶对高脂血症大鼠血液和肝脏脂质的影响[J].浙江大学学报(农业与生命科学版),2004,30(5):510-514.
[2] 司艳红,商战平,王家富,等.蜂胶对高脂饲料诱导的动脉粥样硬化家兔的干预作用[J].中国临床康复,2005,9(35):82-84.
[3] 赵水平,董静,倪占玲,等.烟酸促进小鼠体内胆固醇逆转运[J].中国动脉硬化杂志,2008,25(9):1 588-590.
[4]Naik SU,Wang X,Da Silva JS,et al.Pharmacological activation of liverX receptors promotes reverse cholesterol transport in vivo[J].Circula-tion,2006,113(8):90-97.
[5]Trigatti BL,Rigotti A,Braun A.Cellular and physiological roles of SR-BⅠ,a lipoprotein receptor which mediates selective lipid uptake[J].Bio-chim Biophys Acta,2000,1 529(1-3):276-286.
[6]Gomset JA,Norum KR.The metabolic role of lecithin:cholesterol acyl-transferase:perspectives from pathology[J].Adv Lipid Res,1973,11:1-65.
[7]Zhang Y,Da Silva JR,Reilly M,et al.Hepatic expression of scavengerreceptor class B type I(SR-BI)is a positive regulator of macrophage reversecholesterol transport in vivo[J].JClin Invest,2005,115(10):2 870-874.
[8]Remaley AT,Amar Mand Sviridov D.HDL-replacement therapy:mecha-nism of action,types of agents and potential clinical indications[J].Ex-pert Rev Cardiovasc Ther,2008,6:1 203-215.
[9]Duffy D and Rader DJ.Emerging therapies targeting high-density lipopro-tein metabolism and reverse cholesterol transport[J].Circulation,2006,113:1 140-150.
[10]Remaley AT,Stonik JA,Demosky SJ,et al.Apolipoprotein specificityfor lipid efflux by the human ABCAI transporter[J].Biochem BiophysRes Commun,2001,280:818-823.
[11]Matsuura F,Wang N,Chen W,et al.HDL from CETP-deficient sub-jects shows enhanced ability to promote cholesterol efflux from macrophagesin an apoE-and ABCG1-dependent pathway[J].J Clin Invest,2006,116:1 435-442.
[12]Alam K,Meidell RS and Spady DK.Effect of up-regulating individualsteps in the reverse cholesterol transport pathway on reverse cholesteroltransport in normolipidemic mice[J].J Biol Chem,2001,276:15 641-649.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-