摘要:目的研究蜂胶总黄酮(TFP)对自发性糖尿病大鼠糖脂代谢的影响。
方法:
将50只自发性糖尿病大鼠按血糖值随机分为对照组、消渴丸组(2000mg·kg-1)、蜂胶总黄酮高剂量组(240mg·kg-1)、中剂量组(120mg·kg-1 )、低剂量组(60 mg·kg-1)。各组大鼠每天灌胃给药1次,连续8周,对照组灌胃同体积羧甲基纤维素钠溶液。末次给药结束后,禁食12h,乙醚麻醉,腹主动脉取血,检测自发性糖尿病大鼠血清中血糖(Glu)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、糖化血红蛋白(GHb)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)、胰岛素(INS)、C肽(C-P)、肿瘤坏死因子(TNF-α)、游离脂肪酸(FFA)、一氧化氮(NO)及肝糖原水平。结果 与对照组比较,蜂 胶总黄酮高、中、低剂量组血糖、甘油三酯、总胆固醇、低密度脂蛋白胆固醇、丙二醛及肿瘤坏死因子-α水平明显降低(P<0.05或P<0.01或P<0.001),高密度脂蛋白胆固醇、超氧化物歧化酶、胰岛素、C肽及肝糖原含量明显升高(P<0.05或P<0.01或P<0.001);蜂胶总黄酮高、中剂量组糖化血红蛋白及游离脂肪酸水平明显降低(P<0.05或P<0.01或P<0.001),谷胱甘肽及一氧化氮含量明显升高(P<0.05或P<0.01),低剂量组则无显著性差异(P>0.05)。消渴丸组超氧化物歧化酶、肝糖原、一氧化氮及C肽明显升高(P<0.05或P<0.01),血糖、丙二醛、甘油三酯及糖化血红蛋白水平明显降低(P<0.05或P<0.01或P<0.001),对其他指标则无明显影响(P>0.05)。
结论:蜂胶总黄酮可明显降低自发性糖尿病大鼠血糖水平,明显改善自发性糖尿病大鼠糖脂代谢及抑制胰岛素抵抗。
杨明 隋殿军 陈文学 杨铭 于德伟 (吉林省中医药科学院,长春130012;长春中医药大学,长春130021)
关键词:蜂胶总黄酮;糖尿病;自发性糖尿病大鼠;糖脂代谢;胰岛素抵抗
蜂胶是工蜂从植物嫩芽中有选择地采集而来的树脂,并混入蜜蜂上颚分泌物以及少量蜂蜡加工而成 的黏胶状混合物[1],具有解毒消肿,收敛生肌的作用,用于体虚早衰,高脂血症,消渴等症,是一味既可内服,又可外用的常用中药[2]。蜂胶中主要包括黄酮类化合物、芳香酸与芳香酸酯、萜烯类化合物、甾体化合物、氨基酸、糖类化合物等成分[3]。其中,黄酮类化合物为蜂胶有效成分之一。我们从蜂胶中分离纯化出蜂胶总黄酮(TFP),总黄酮含量为52.1%。本实验选 用自发性糖尿病大鼠(GK)作为糖尿病动物模型,探讨TFP对GK大鼠降血糖作用及其机制。
1 材料与方法
1.1 实验动物及饲料
GK大鼠50只,雄性,240~280g(上海斯莱克实验动物有限责任公司,合格证号2007000518227)。高脂饲料(普通饲料88.2%、猪油10%、胆固醇1.5%、 猪胆盐0.3%,吉林大学动物中心)。
1.2 药品
取蜂胶药材,-4℃~4℃冷冻4~6h,粉碎成粗粉,与蜂胶质量六分之一的乙醇混合,置萃取罐中,萃取压力20~30MPa,萃取温度为40~60℃,萃取3~5h;分离釜压为6.0~7.0MPa;减压回收溶液,得萃取物;减压干燥,粉碎成细粉。采用盐酸-镁粉显色反应鉴定提取物为总黄酮类化合物。以芦丁为对照品采用分光光度计法测定总黄酮含量,以高效液相色谱法测定白杨素、高良姜素的含量,作为本品质量控制的指标。总黄酮含量以芦丁计高于50.0%,白杨素含量高于5.0%,高良姜素含量高于6.0%。实验时用0.5%CMC-Na配成所需浓度。消渴丸(广州中一药业有限公司,批号:NO1166)。
1.3 试剂
葡萄糖测定试剂盒(葡萄糖氧化酶法,批号:2010017)、总胆固醇测定试剂盒(COD-PAP法,批号:2010008)、甘油三酯测定试剂盒(GPO-PAP法,批号:2010008)(长春汇力生物技术有限公司);一氧化氮试剂盒(硝酸还原酶法,批号:20100336)、游离脂肪酸测试盒(批号:20100214)、超氧化物歧化酶测试盒(批号:20100709)、丙二醛测定试剂盒(批号:20100708)、谷胱甘肽测定试剂盒(批号:20100707)、肝糖原测定试剂盒(批号:2010114)(南京建成生物工程研究所);RatC-PELISAKit(LOT#C105-09)、RatINSELISAKit(LOT#I093-09)、RatTNF-αELISAKit(LOT#T041-09)(GroundworkBio-technologyDiagnosticateLtd)。
1.4 仪器
T6紫外可见分光光度计(北京普利生有限公司);ST-360酶标仪(上海科华实验系统有限公司);LC-10AVP高效液相色谱仪(日本岛津公司)。
1.5 动物分组及给药
取GK大鼠50只,适应性喂养7d后,尾尖取血测血糖,根据血糖值随机分为对照组、消渴丸组(阳性药对照组2000mg·kg-1 )、蜂胶总黄酮高剂量组 (240mg·kg-1)、中剂量组(120mg·kg-1 )、低剂量组(60mg·kg-1 ),每组10只。蜂胶总黄酮各剂量组 与阳性药对照组以10mL·kg-1 体重剂量灌胃给药, 每日1次,连续8周,对照组给予同体积的0.5% CMC-Na。给药期间,各组大鼠均继续喂以高脂饲料。每周测量血糖1次。末次给药结束后,禁食12h,乙醚麻醉,腹主动脉取血,检测GK大鼠血清中血糖(Glu)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、糖化血红蛋白(GHb)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)、胰岛素(INS)、C肽、肿瘤坏死因子(TNF-α)、游离脂肪酸(FFA),一氧化氮(NO)及肝糖原水平。
1.6 统计学分析
PASWStatistics17.0版统计分析软件,多组之间采用单因素方差分析比较,组间比较采用t检验, 结果以珋x±s表示。
2 结 果
2.1 蜂胶总黄酮对GK大鼠血糖的变化
与模型对照组比较,在各个观察时间点,TFP高剂量组GK大鼠血糖含量均明显降低(P<0.05或 P<0.01或P<0.001);中剂量组大鼠血糖含量在给药第3周后,出现明显降低(P<0.05或P<0.01或P<0.001);低剂量组大鼠血糖在给药第4周后,出现明显降低(P<0.05或P<0.01或P<0.001),给药前三周低剂量大鼠血糖含量均低于对照组,但无统计学差异(P>0.05)。阳性药组大鼠血糖含量在给药第4周后,出现明显降低(P<0.05或P<0.01或P<0.001)。见表1。
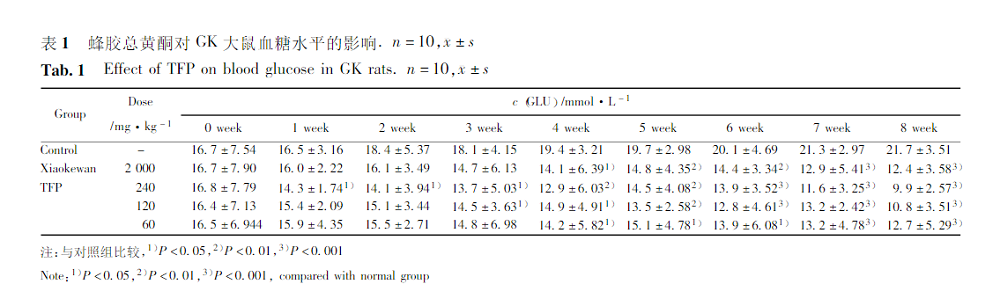
2.2 蜂胶总黄酮对GK大鼠SOD、MDA、GSH、TC、TG、HDL-C及LDL-C的影响
与对照组比较,TFP高剂量组与中剂量组大鼠TG、TC、LDL-C及MDA水平均低于对照组(P<0.05或P<0.01或P<0.001),HDL-C、SOD及GSH水平明显高于对照组(P<0.05或P<0.01或P<0.001);低剂量组大鼠HDL-C、SOD水平明显升 高(P<0.05), TG、TC、LDL-C及MDA水平均明显降低(P<0.05),GSH高于对照组,但无统计学差异 (P>0.05)。阳性药组大鼠SOD明显升高(P<0.01),MDA与TG明显降低(P<0.05)。见表2。
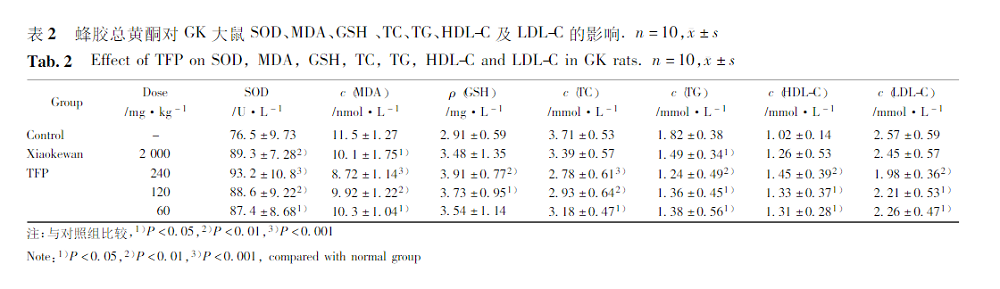
2.3 蜂胶总黄酮对GK大鼠GHb、肝糖原、FFA、TNF-α、NO、C-P及INS的影响
与对照组比较,TFP高剂量组与中剂量组大鼠GHb、FFA及TNF-α水平明显降低(P<0.05或P<0.01或P<0.001),肝糖原、C-P、NO及INS水平则明显升高(P<0.05或P<0.01或P<0.001);低剂量组大鼠GHb、TNF-α明显降低(P<0.05),肝糖原、INS及C-P水平明显升高(P<0.05),FFA水平低于对照组,NO水平高于对照组,但均无统计学差异(P>0.05)。阳性药组GHb明显降低(P<0.05),肝糖原、 NO、C-P明显升高(P<0.05或P<0.01)。见表3。
3 讨论
在本次实验研究中选用发病机制与临床2型糖尿病的发病机制极为相似的GK大鼠作为糖尿病模型大鼠[4]。GK大鼠在糖尿病发作后,快速出现高血糖、INS分泌减弱等症状,后期出现视网膜病、微 血管病、神经病、肾病等并发症[5]。被广泛应用于2 型糖尿病及其并发症的研究中。本实验结果表明,TFP与消渴丸均可明显降低GK大鼠血糖、GHb水平,升高肝糖原水平。提示, TFP与消渴丸均可明显改善糖尿病糖代谢紊乱状况。INS是由胰岛β细胞分泌,它是体内唯一降低血糖的激素,它能促进全身组织细胞对葡萄糖的摄取和利用。C-P与INS呈等分子关系,能真实反映INS分泌水平[6], C-P还具有稳定性强、不受外源性INS和血中INS抗体的影响等特点,是自身INS分泌能力的一个良好指标[7]。本实验结果表明,与对照组相比,消渴丸可明显升高GK大鼠C-P水平,但对INS无明显影响。TFP可明显升高GK大鼠C-P及INS水平。笔者认为GK糖尿病大鼠血糖及GHb水平降低,可能与TFP调节GK糖尿病大鼠胰腺β细胞分泌功能以及肝糖原合成增加有关。
2型糖尿病常伴有脂质代谢紊乱,脂质代谢异常又进一步加重糖代谢紊乱,二者互为因果关系。主要表现为HDL-C水平的降低,TC、TG、LDL-C水平的升高[8]。本实验结果显示,与对照组比较,消渴丸可明显降低TG水平,TC及LDL-C水平低于对照组,HDL-C水平高于对照组,但无统计学差异。TFP可明显降低GK大鼠TC、TG及LDL-C水平,升高HDL-C水平。提示TFP可明显改善GK大鼠脂代谢紊乱,对糖尿病脂肪代谢并发症具有一定的防治作用。糖尿病患者体内脂质代谢紊乱的同时,也存在自由基代谢紊乱,即MDA升高、 SOD降低的现象。SOD活性和MDA的含量是反映机体氧化水平 的可靠指标,可以间接地反映胰腺损伤的程度 [9-11]。GSH是一种低分子自由基、过氧化氢和脂质过氧化物清除剂,是细胞内最重要的清除毒物的内源性物质,体内自由基过多会导致GSH耗竭[12] 。本实验研究发现,与对照组比较,TFP与消渴丸可明显降低血清中MDA含量,升高SOD水平;TFP可升高GSH水平,消渴丸则无明显影响。表明TFP与消渴丸可增强机体抗氧化能力,保护糖尿病机体免受自由基进一步氧化损伤。
TNF-α是机体重要细胞因子之一,主要由活跃的单核巨噬细胞受脂多糖刺激产生[13]。TNF-α与 血浆INS水平、葡萄糖代谢及脂质代谢密切相关,高水平的TNF-α可以抑制INS的功能,诱导高INS血症,加强胰岛抵抗[14]。糖尿病时血中FFA水平也明显升高,升高的FFA可增加组织细胞膜的流动性,使镶嵌在脂质双分子层内的INS受体数量和活性降低,从而降低组织对INS的敏感性,加重INS抵抗[15]。本实验中,TFP可明显降低GK大鼠TNF-α、FFA水平,表明TFP具有调节INS水平、抑制INS抵抗的作用。
糖尿病血管并发症的发生发展与NO水平下降密切相关[16]。本实验结果提示,与对照组相比,TFP与消渴丸可明显升高GK大鼠NO水平,降低微血栓的形成。由此可说明,TFP与消渴丸对糖尿病大鼠NO水平具有较好的调节能力。
综上所述, TFP可明显降低GK大鼠血糖水平其降糖机制可能与改善GK大鼠INS抵抗、糖脂代谢紊乱、清除自由基及抗脂质过氧化有关。
参考文献:
[1] YANGM,SUIDJ,ZHUS,etal.Effectofthetotalflavonesof propolis(TFP)onFas,BaxandBcl-2proteinexpressioninmyo-cardialischemie-reperfusedinjuryrats[J].ChinPharmacolBull(中国药理学通报),2005,21(7):799-803.
[2] WANGXN,DUJ,HUANGYY,etal.Observationonthean-ti-inflammatoryactionofpropolisforexternaluse[J].ChinExpTradMedFormuJ(中国实验方剂学杂志),2012,18(8):234-237.
[3] HUFL,ZHANRF,CHENLM,etal.Effectsofpropolison bloodlipidandliverofhyperlipidemicSDrats[J].JZhejiangUniv(浙江大学学报),2004,30(5):510-514.
[4] WANGZC,NIUJ,YANGLX,etal.Experimentalresearchof effectonurineproteininGKratbyTangnaikang[J].JEmergTraditChinMed(中国中医急症),2009,18(4):579-614.
[5] PORTHAB.Programmeddisordersofβ-celldevelopmentandfunc-tionasonecausefortype2diabetes[J].DiabetesMetabResRev,2005,21(6):495-504.
[6] CHENFS,HOUXL,ZHOUR,etal.Studyofcorrelationbe-tweenC-reactiveProtein,tumornecrosisfactor-alphaandinsulin resistanceinpatientswithtype2diabetes[J].ChinaJChinMed(中医学报),2010,25(148):527-528.
[7] HUOJ,FUHJ.Relationshipsbetweenfreefattyacidsandpan-creaticbeta-cellfunctionorinsulinresistance[J].WestChina MedJ(华西医学),2010,25(7):1255-1258.
[8] GUOJJ,WANGXJ,ZHAOYL,etal.TheeffectofYiqihua-zhuocapsuleonserumtriglycerideandcholesteroloftype2dia-betesKKAymouse[J].GuideChinMed(中国医药指南), 2012,10(32):2-4.
[9] WUFH,LIANGJY,YUP,etal.Studiesonthehypoglycemia andlipidsregulatingeffectsofPlantagodepressaVar.montata[J].ChinaJChinMaterMed(中国中药杂志),2005,30(15):1179-1181.
[10] TIANDN,WUFH,MASC,etal.Studyonanti-hyperglyce-miceffectanditsmechanismofclinopodiumchinense[J].ChinJ ChinMaterMed(中国中药杂志),2008,33(11):1313-1316.
[11] IANGHF,LIXR,CHENXL,etal.Effectofpurplesweet potatoflavonidsonbloodglucoseandoxidativestressindiabeticrats[J].ChinPharmJ(中国药学杂志),2011,46(20):1570-1573.
[12] XIEXM,PANGXB,LIXT,etal.Hypoglycemiceffectand mechanismofraspberryketoneondiabeticmodelmice[J].ChinPharmJ(中国药学杂志),2012,47(23):1899-1094.
[13] HUAZQ,CHANGYJ.EffectofWuhuangtangkanglingoncyto-kineinpatientswithtype2diabetesmellitus[J].ChinaJChin MaterMed(中国中药杂志),2013,38(4):622-624.
[14] WUYH,ZHANGH,SUXY,etal.EffectofYiqiyangyinand Huoxuerecipeonglucoseandlipidmetalolismandleptininratswithtype-2diabetesmellitus[J].JLiaoningUnivTraditChin Med(辽宁中医药大学学报),2009,11(5):205-207.
[15] SUNJ,XIECC,JIAZ,etal.Effectofacupunctureonfree acidcontentofexperimentalratswithinsulinresistance[J].JShandongUnivTraditChinMed(山东中医药大学学报),2009,33(3):246-247.
[16] ACHERSL,HUANGJMC,HAMPLV,etal.Nitricoxide andcGMPcausevasorelaxationbyactivationofacharbolotoxinsensitiveKchannelbycGMP-dependentproteinkinase[J].Proc NatlAcadSciUSA,1994,91(16):7583-7587.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-




