【摘要】目的:观察蜂胶对四氧嘧啶糖尿病大鼠创面表皮干细胞动员的影响。方法:健康Wistar大鼠被随机分为4组:盐水对照组(n=18)、蜂胶对照组(n=18)、盐水模型组(n=22)和蜂胶模型组(n=18)。模型组大鼠为尾静脉注射四氧嘧啶制造的糖尿病模型。造模4周后所有大鼠背部两侧制造直径1.8cm的圆形全皮层皮肤创面。分别用盐水或蜂胶处理伤口,观察各组的创面愈合时间。免疫组化法检测角蛋白14(K14)、角蛋白19(K19)、整合素β1的表达;Western Blot测定K19、整合素β1的蛋白表达水平。结果:与盐水处理相比,蜂胶能明显缩短创面愈合时间(P<0.01),促进创面K14、K19、整合素β1的表达(P<0.01)。结论:蜂胶可以促进糖尿病大鼠创面表皮干细胞活性,加速创面愈合。
【作者】 高畅 贾军宏 楚勤英 唐志雄 马虹颖 李建华 傅小玲 王进伟
【关键词】糖尿病 蜂胶 创面愈合 表皮干细胞
蜂胶是蜜蜂采集植物的树脂,并混和自身的唾液和蜂蜡,咀嚼而成的一种有粘性的胶状物质。有研究表明蜂胶中包含了超过300种已知的物质,其主要成份为类黄酮、萜类、酚类、酯类、矿物质、维生素、脂肪酸等[1]。蜂胶复杂的生物学活性决定了它多样的药理学活性,其中抗菌、抗氧化、抗炎作用可促进创面的愈合[2]。
表皮干细胞(epidermal stem cells,ESCs)作为皮肤组织的特异性干细胞,不仅是维持着皮肤新陈代谢的功能,而且与创面修复紧密相关[3]。目前,常用整合素β1(integrinβ1)和角蛋白19(keratin19,K19)同时染色阳性来鉴别ESCs[4],用K14染色阳性来鉴别短暂扩增细胞[5]。本实验在四氧嘧啶诱导的糖尿病大鼠创面模型上,观察蜂胶对创面ESCs阳性表达及创面愈合时间的影响。
1 材料与方法
1.1 实验动物与材料
健康Wistar大鼠80只,雌雄各半,体重250~275g,SPF级,由军事医学科学院动物中心提供。蜂胶(澳洲尤加利蜂胶精华液)进口批准文号为:国食健字J20050020;四氧嘧啶购自美国Sigma公司;K14、K19、整合素β1一抗(福州迈新生物技术开发有限公司产);免疫组化两步法试剂盒(北京中杉金桥生物试剂有限公司产);血糖仪及试纸(拜尔公司,拜安捷);显微镜(奥林巴斯BX51)。
1.2 实验方法
1.2.1 糖尿病大鼠模型的制备
将大鼠随机分组:对照组36只和模型组44只。将模型组大鼠禁食12h后尾静脉注射四氧嘧啶45mg/kg,注射后大鼠自由饮食。1周后测血糖,随机血糖>11.1mmol/L者为糖尿病大鼠。连续4周每周1次监测所有造模大鼠的随机血糖,同时观察体重、饲料消耗量、饮水量和排尿量。模型组大鼠持续血糖升高,体重下降,出现多食、多饮、多尿症状,其中40只随机血糖在16.7~28.7mmol/L,造模成功。
1.2.2 大鼠背部全皮层皮肤创面模型的制备
糖尿病大鼠造模4周后,与对照组大鼠同时腹腔注射10%水合氯醛(0.3ml/kg)麻醉,固定于操作台上,剪去背部毛发,75%酒精和碘伏消毒背部皮肤,用特制打孔器切去大鼠背部两侧直径1.8cm、面积为2.54cm2的全皮层皮肤组织,造成2个创面深达皮下组织的伤口[6]。对照组大鼠随机分为2组,每组18只,分别用盐水和蜂胶处理伤口。造模大鼠随机分为2组,22只采用生理盐水冲洗伤口;18只伤口表面滴加蜂胶4滴。4组大鼠处理后均用无菌凡士林沙条覆盖伤口,无菌纱布包扎固定。单笼饲养,每日换药,自由饮食。
1.2.3 观察指标
观察记录创面上皮完全愈合所需要的时间。伤后3、7、14d,每组处死4只大鼠,取创面组织置于4%多聚甲醛中固定,石蜡包埋。用免疫组化两步法染色,分析创面K14、K19、整合素β1的阳性表达。K14、K19、整合素β1主要在毛囊隆突部及基底层表达,染成棕黄色为阳性表达。在200倍光镜下,随即选取5个视野拍照,采用美国Image-pro Plus(IPP)6.0图像分析软件分析阳性细胞的表达情况。统计各指标的阳性单位(positive unit,PU)[7]。PU值是反映ESCs表达情况的评价指标。
取d7冻存组织,Western Blot检测K19、整合素β1的蛋白表达水平。
1.3 统计学方法
应用SPSS11.5软件学软件,多组间比较采用单因素方差分析(ANOVA)。
2 结果
2.1对糖尿病大鼠皮肤创面愈合的影响
Wistar大鼠制备全皮层皮肤缺损创面后,模型鼠创面愈合水平较对照组明显缓慢。创后14d时盐水模型鼠(图1a,封底)和蜂胶模型鼠的图片(图1b,封底)可见,盐水模型鼠表面脓性渗液较多,伤口面积明显大于蜂胶模型鼠,蜂胶模型鼠创面相对干净,渗出少,愈合速度较快。
观察各组大鼠的创面愈合时间:盐水模型组(30.5±3.4d)显著长于盐水对照组(24.5±3.0d)和蜂胶模型组(26.1±2.1d),均P<0.01;蜂胶对照组的创面愈合时间(21.3±2.1d)显著短于盐水对照组(P<0.05)。
2.2 免疫组化分析结果
表1示,各时间点对照组K14阳性表达细胞PU值均显著高于模型组(P<0.01,P<0.05);蜂胶模型组在各时间点K14阳性表达细胞PU值均显著高于盐水模型组(P<0.01,P<0.05)(图2,封底);蜂胶对照组d7时K14阳性表达细胞PU值高于盐水对照鼠(P<0.05)。
表2示,各时间点对照组K19阳性表达细胞PU值均显著高于模型组(P<0.01);在d3、d7、d14,蜂胶模型组K19阳性表达细胞PU值均高于盐水对照鼠(P<0.05,P<0.01)。
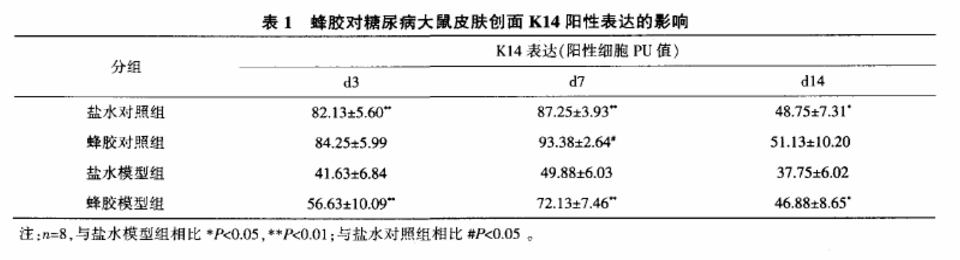
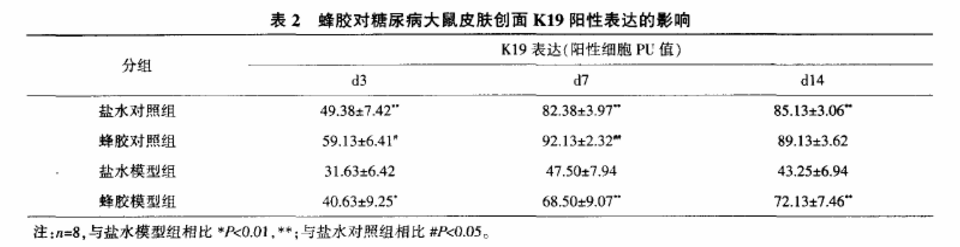
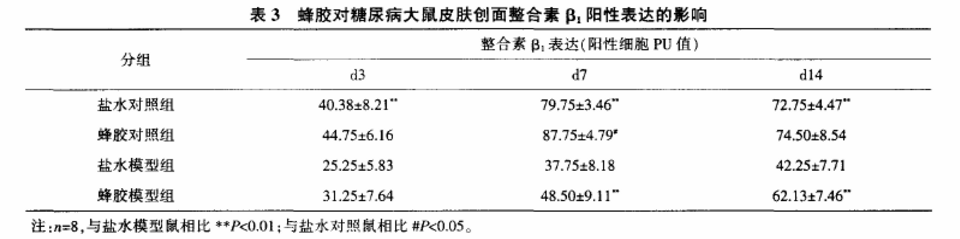
注:n=8,与盐水模型鼠相比**P<0.01;与盐水对照鼠相比##P<0.01。
表3示,各时间点对照组整合素β1阳性表达细胞PU值均明显高于模型鼠(P<0.01);在d7、d14,蜂胶模型组整合素β1阳性表达细胞PU值均显著高于盐水模型组(P<0.01,图4见封底);d7蜂胶对照组显著高于盐水对照组(P<0.05)。
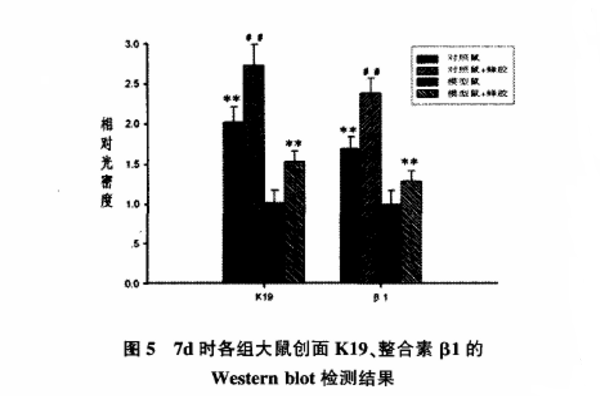
2.3 Western Blot分析结果
伤后d7盐水对照组的K19蛋白水平(2.02±0.19)显著高于模型组(P<0.01);蜂胶模型组(1.53±0.13)显著高于盐水模型组(P<0.01);蜂胶对照组(2.73±0.26)显著高于盐水对照组(P<0.01,图5)。伤后d7整合素β1的蛋白质表达,各组结果与K19相似,见图5。
3 讨论
本实验采用尾静脉注射四氧嘧啶制备糖尿病大鼠模型,伤后30d大鼠一直维持较高的血糖水平,每10d测模型组大鼠随机血糖均稳定升高在11.1~26.7mmol/L之间,糖尿病模型稳定可靠。
皮肤受创伤时,ESCs数量及分布发生变化,参与创面修复,ESCs在创面再上皮化过程中是各层表皮细胞的源细胞。角蛋白是上皮细胞的结构蛋白和主要功能蛋白,在细胞内形成广泛的网状结构,随分化程度的不同,表皮细胞表达不同的角蛋白,因而可用于鉴别ESCs、短暂扩增细胞和终末分化细胞。整合素为一类位于细胞膜表面的糖蛋白受体家族分子,主要介导细胞与细胞外基质的黏附,表皮基底细胞表达整合素β1。目前,常用整合素β1和K19同时染色阳性来鉴别ESCs,用K14染色阳性来鉴别短暂扩增细胞。
试验结果表明,K14、K19、整合素β1的表达在四氧嘧啶诱导的糖尿病大鼠皮肤创面中远远低于正常大鼠,四氧嘧啶造成的高血糖状态明显影响了创面ESCs活性,从创面愈合过程中ESCs的动态变化看,ESCs的数量少和活性低是导致糖尿病创面愈合延迟的重要原因。各组大鼠创面K14、K19、整合素β1的表达对比均表明蜂胶对糖尿病大鼠创面ESCs活性更具促进作用,这可能是因为正常大鼠受创后,干细胞活性增强,已处于较高水平,因而蜂胶对其促进效果有限。而糖尿病大鼠因高血糖造成愈合功能损伤,受创后干细胞活性虽增强,但较正常大鼠大幅下降,因而采用蜂胶治疗后,效果更为明显。在创面的修复过程中,糖尿病大鼠各时期ESCs数量及活性均低于正常大鼠,可能是糖尿病状态下ESCs“储备”不足或过早向终末分化细胞分化所致。有研究指出,糖尿病大鼠皮肤基底层的干细胞库出现“干涸现象”或/和细胞功能失调,直接导致了糖尿病大鼠皮肤变薄和伤口难愈,后者可能与糖尿病大鼠皮肤干细胞微环境,即供给干细胞营养的微血管、神经等失调有关[8]。
蜂胶中含有丰富的类黄酮、萜类、芳香酸等药理活性成分,类黄酮可促进胶原蛋白的合成,而且类黄酮和其它成份还具有抗菌消炎的功能。本研究从ESCs动员的情况进行探讨,实验结果提示蜂胶可以促进创面ESCs动员,明显加快糖尿病大鼠及正常大鼠创面的愈合速度,在创面治疗特别是糖尿病创面治疗方面有一定的应用前景。
参考文献:
[1]Bankova V,Popova M,Bogdanov S,et al.Chemical Composi-tion of European Propolis:Expected and Unexpected Results[J].Z Naturforsch,2002,57c:530-533.
[2]Banskota AH,Tezuka Y,Kadota S.Recent progress in phar-macological research of propolis[J].Phytother Res,2001,15(7):561-571.
[3]Janes SM,Lowell S,Hutter C.Epidermal stem cells[J].J Pathol,2002,197(4):479-491.
[4]Michel M,Torok N,Godbout MJ,et al.Keratin19as a bio-chemical marker of skin stem cells in vivo and in vitro:Keratin19expressing cells are differentially localized in function of anatomic sites,and their number varies with donor age and culture stage[J].Journal of Cell Science,1996,109(5):1017-1028.
[5]李延仓,李孝建,沈雁.表皮干细胞标记物鉴定及应用现状[J].中国组织工程研究与临床康复,2007,11(46):9329-9332.
[6]付小兵,王亚平,孙同柱,等.糖尿病慢性难愈合创面大鼠模型的制备[J].上海实验动物科学,1997,17(4):217-219.
[7]申洪.免疫组织化学显色反应强度定量方法研究[J].中国组织化学与细胞化学杂志,1995,4(1):89-92.
[8]刘育杰,赖西南,郭文治,等.表皮干细胞在不同病期糖尿病大鼠皮肤中的分布规律[J].中国临床康复,2005,9(3):125-127.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-




