【摘要】采用体外细胞培养实验方法,应用四甲基偶氮唑蓝法、流式细胞仪检测、共聚焦显微镜技术,观察蜂胶对喉鳞癌Hep-2细胞的抑制率、凋亡率的影响及细胞内Ca2+变化。细胞抑制率随用药时间的延长、剂量增加而增大。蜂胶能诱导喉鳞癌细胞凋亡,非特异性地阻滞Hep-2细胞周期的全过程。细胞内Ca2+随药物浓度的增加而升高(P<0.05)。认为蜂胶有诱导Hep-2细胞凋亡的作用,其机制可能与细胞内Ca2+变化有关。
【作者】 王菊香 张向阳 门金娥 裴士庚 张虹 郑海平
【关键词】蜂胶 喉肿瘤 Hep-2细胞 细胞凋亡
蜂胶是蜜蜂从植物的幼芽及树木的枝条上采集的树脂类物质,与其唾液混合加工成一种芳香性胶状固体物,既往实验表明[1],蜂胶影响肿瘤细胞DNA活性,提高机体免疫力,与放化疗联用有增效减毒作用等。为进一步探讨其作用机制,2007年5~7月,我们观察了蜂胶对人喉鳞癌Hep-2细胞的诱导凋亡作用及其与细胞内Ca2+的关系。
1材料与方法
1.1材料
①蜂胶提取物:取本地产蜂胶,冰冻粉碎后以95%乙醇浸泡72 h,过滤,滤液于40℃减压挥发干溶剂,二甲基亚砜(DMSO)溶解定容为2 mg/m。l实验前用RPMI 1640(美国Gibco公司)稀释成20、40、80、160μg/m。lDMSO的浓度<0.02%。
②主要试剂及仪器:RPMI 1640培养液(美国Gibco公司),荧光染料Fluo-3乙/酰羟甲基酯(AM)(BIO-RAD公司)。BIO-RAD550酶标仪、FACSCalibur流式细胞仪(FCM,美国BECTON DICKINSON公司),MRC-1024激光共聚焦显微镜(BIO-RAD公司)。
③Hep-2细胞株由白求恩国际和平医院耳鼻喉头颈外科实验室惠赠。
1.2实验方法
1.2.1 Hep-2细胞抑制率的检测
应用四甲基偶氮唑蓝(MTT)法测定。当Hep-2细胞数达到106时接种到96孔板,每孔加细胞1×104/50μl,在对数生长期加入不同浓度的蜂胶(实验组),使培养基终浓度分别为20(A组)、40(B组)、80(C组)、160(D组)μg/m l,分别作用24(T1)、48(T2)、72(T3)h后,加MTT 4 h后,弃上清液,加入DMSO充分溶解,形成结晶,用酶标仪测OD值(570 nm),计算出细胞抑制率。对照组除不加蜂胶外,其他操作与实验组相同。
1.2.2 Hep-2细胞凋亡率的检测
取对数生长期Hep-2细胞,加入80μg/ml的蜂胶分别作用T1~T3,用PBS洗涤2遍,柠檬酸缓冲液固定1 h,加1 800μl的胰酶消化液充分消化,加入碘化丙啶(PI)1 500μl作用15 m in,过滤,用FCM进行细胞凋亡检测和细胞周期分析。
1.2.3 Hep-2细胞内Ca2+变化的检测取对数生长期Hep-2细胞,用D-Hanks液洗涤2次,于37℃避光条件下用Fluo-3/AM(10μm/L)荷载。40 min后用D-Hanks液洗涤细胞3次,洗去细胞外残余染料,最后保留少许细胞外D-Hanks缓冲液,平衡10 min。经不同浓度蜂胶作用不同时间,在激光共聚焦显微镜下扫描两组细胞内荧光强度,激发波长488 nm发射波长526 nm,以本底荧光强度为参照(0),检测细胞内Ca2+荧光强度。
1.3 统计学方法计量资料用x±s表示。用SPSS10.0软件,对数据进行LSD-t检验。α=0.05。
2 结果
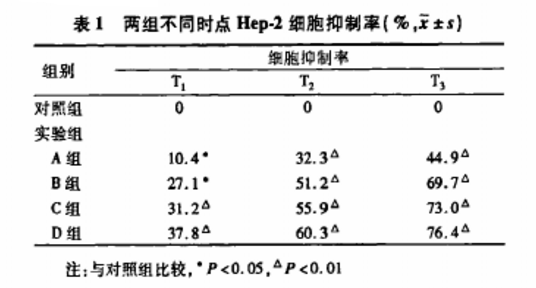
2.1蜂胶对Hep-2细胞抑制率的影响 详见表1。
蜂胶对Hep-2细胞具有明显的抑制作用,实验组与对照组比较,P<0.05。抑制作用有一定的剂量、时间依赖关系。
2.2 80μg/m l的蜂胶对Hep-2细胞凋亡率的影响
T1、T2、T3时Hep-2细胞抑制率分别为36·2%、44·5%、58·6%,且作用时间越长,细胞凋亡率越高(P<0·05)。T1、T2、T3时G0/G1期细胞分别占67·2%、55·8%、59·4%,S期分别占19·1%、28·3%、33·5%,G2/M期分别占13·7%、15·9%、7·1%。
2.3 Hep-2细胞内Ca2+的变化详见表2。随药物浓度的增加,细胞内Ca2+荧光强度亦增高〈P均<0.05。

3 讨论
蜂胶是蜜蜂从植物的幼芽及树干上采集的树脂,并混入其上腭腺分泌物、蜂蜡和少量的花粉加工而成的一种具有芳香气味的胶状固体物。目前已知蜂胶中所含抗癌有效成分有黄酮类、萜烯类、多糖物质、酯类化合物等及其他化合物的天然组合,它们之间相互协调作用,赋予了蜂胶的抗癌作用[1]。动物实验表明,蜂胶可抑制由化学致癌物诱发的肿瘤[2,3]。由于放化疗在杀伤肿瘤细胞的同时,也会损伤机体的免疫活性细胞及造血细胞,因此强化机体免疫效果,对抗放化疗引起的毒性反应,是当今肿瘤防治工作重要任务之一。本实验结果表明,蜂胶确有诱导喉鳞癌Hep-2细胞凋亡的作用,且有一定的剂量、时间依赖关系;可诱导Hep-2细胞凋亡,且对细胞周期有一定的影响,既可影响细胞周期G1期向S期转变,又可影响S期向G2/M期的转变过程,导致肿瘤细胞凋亡,非特异性阻滞细胞周期的全过程。Ca2+信号传导在细胞凋亡机制研究中的作用日益受到人们重视。在大多数细胞凋亡过程中,细胞内Ca2+均有所增加[4~6]。本实验结果显示,蜂胶作用后Hep-2细胞内Ca2+相对荧光强度明显高于对照组,且随着药物浓度的增高,Ca2+荧光强度亦增高,P均<0.05。提示Ca2+的变化在蜂胶诱导Hep-2细胞凋亡中起重要作用,可能系其诱导凋亡的关键机制之一。
总之,本实验为蜂胶抗喉癌效应提供了初步依据。要进一步证实蜂胶的体内抗喉癌效果,尚需进行一系列实验后才可作出综合判断。
参考文献:
[1]郭芳彬.蜂胶的抗癌作用[J].蜜蜂杂志,2003,9(1):10-13.
[2]Rao CV,Desai D,Smith B,et al.Inhibitory effect of caffeic acid es-ters on azoxy-methane-induced biochemcial changes and abberrantcrypt foci formation in rat colon[J].Cancer Res,1993,53(18):4182-4188.
[3]Rao CV,Resai D,Rivenson A,et al.Chemoprevention of colon carci-nogenesis by phenylethyl-3-methyl caffeate[J].Cancer Res,1995,55(11):2310-2315.
[4]Kluck RM,McDougall CA,Harmon BV,et al.Calcium chelators in-duce apoptosis evidence that raised intracellularionised calcium isnotessential for apoptosis[J].Biochim Biophys Acta,1994,1223(2):247-254.
[5]McGinnis KM,Wang KK,Gnegy ME.Alterations of extracellular cal-cium elicit selective modes of cell death and protease activation in SHSY5Y human neuroblastoma cells[J].J Neurochem,1999,72(5):1853-1863.
[6]王春梅,黄晓峰,杨家骥,等.激光扫描共聚焦显微镜技术[M].西安:第四军医大学出版社,2004:67-89.
- 新渔公众号
- 微信扫一扫
-

- 新渔商城
- 微信扫一扫
-




